Consortium Psychiatricum
2023. Том 4. № 4. С. 39–47
doi:10.17816/CP9300
ISSN: 2712-7672 / 2713-2919 (online)
Применение ядросодержащих клеток пуповинной крови в лечении регрессивного аутизма: клинический случай
Аннотация
ВВЕДЕНИЕ: Последние десятилетия можно отметить усиление интереса к проблеме детского аутизма. При этом, несмотря на значительное продвижение в понимании этиологических и патогенетических аспектов, до сих пор не удалось найти эффективные способы лечения аутизма. Терапия стволовыми клетками показала большие перспективы в лечении и реабилитации пациентов как с неврологическими заболеваниями (ДЦП, гидроцефалия), так и с психическими расстройствами (аутизм, шизофрения).
МЕТОДЫ: В этой статье приводится клинический случай, описывающий применение ядросодержащих клеток пуповинной крови у пациента с регрессивной формой аутизма и резистентностью к стандартным методам терапии. Состояние ребенка оценивалось до лечения и через 6 и 12 месяцев.
РЕЗУЛЬТАТЫ: Клиническое наблюдение, психометрические и инструментальные методы диагностики позволили выявить выраженную положительную динамику в состоянии ребенка в виде развития восприятия, снижения соматосенсорных нарушений, нормализации эмоционального статуса, развития социализации и коммуникативных способностей.
ЗАКЛЮЧЕНИЕ: Мы предполагаем, что полученный результат может быть связан с нормализацией иммунологического статуса нашего пациента на фоне терапии клетками пуповинной крови и считаем необходимым проведение дальнейших исследований эффективности методики с учетом патогенетических механизмов развития аутизма.
Общая информация
Ключевые слова: излечение, терапия, психические расстройства, анализ крови
Рубрика издания: Клинические случаи
Тип материала: научная статья
DOI: https://doi.org/10.17816/CP9300
Получена: 17.05.2023
Принята в печать:
Для цитаты: Морозова Я.В., Смирнов В.Н., Макаров И.В., Емелина Д.А. Применение ядросодержащих клеток пуповинной крови в лечении регрессивного аутизма: клинический случай // Consortium Psychiatricum. 2023. Том 4. № 4. С. 39–47. DOI: 10.17816/CP9300
Полный текст
ВВЕДЕНИЕ
Аутизм представляет собой различные по этиологии и патогенезу врожденные нарушения формирования центральной нервной системы, при которых наблюдаются нарушения в социальных и коммуникативных навыках и повторяющееся, стереотипное поведение [1]. В большинстве случаев причины аутизма тесно связаны с генами, влияющими на созревание синаптических связей в головном мозге, однако генетика заболевания сложна [2–4]. В результате разнообразия причин и механизмов возникновения не существует единого стандарта медикаментозной терапии. Применение лекарств сводится к воздействию на отдельные проявления (агрессия, возбуждение, тревога), но не влияет на ключевые нарушения (коммуникация, социальные навыки, сенсорные нарушения, интеллект и речь) [5–6]. Эффективность применяемых методов невысока, и в большинстве случаев пациенты с аутизмом нетрудоспособны [7].
В связи с недостаточной эффективностью стандартной терапии, разработка новых методов лечения аутизма приобретает первоочередной характер. Одним из важнейших и перспективных направлений в неврологии и психиатрии является использование клеточных технологий, а именно методов коррекции с помощью стволовых клеток [8, 9]. Одним из наиболее доступных источников стволовых клеток является пуповинная кровь. Ранее исследования с применением аллогенных ядросодержащих клеток пуповинной крови (КПК) проводились при таких заболеваниях, как детский церебральный паралич [10, 11], инсульт [12], перинатальная энцефалопатия [13], болезнь Альцгеймера [14], шизофрения [15, 16]. Еще больший интерес вызывает применение ядросодержащих клеток пуповинной крови у пациентов с аутизмом [17–19].
В этой статье представлено описание результатов терапии ядросодержащими клетками пуповинной крови пациента с аутизмом и интеллектуальной недостаточностью. Применение КПК было обусловлено неэффективностью стандартных методов терапии у данного пациента.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациент 8 лет пришел с родителями к психиатру в связи с жалобами матери на отставание ребенка в развитии, гиперактивность, эпизоды возбуждения с агрессией, двигательные стереотипии, выраженные нарушения речи и коммуникативных навыков. Целью обращения служил подбор терапии и определение круга реабилитационных мероприятий.
История болезни
До двух лет ребенок развивался нормально. В возрасте двух лет после перенесенной в тяжелой форме ОРВИ с гипертермией до 40 градусов появились изменения в поведении в виде агрессии и двигательной расторможенности, ребенок утратил приобретенные ранее речевые навыки, перестал реагировать на обращение, появилось стереотипное поведение.
Впервые родители обратились к психиатру, когда ребенку было три года. Был диагностирован атипичный аутизм с умственной отсталостью (F 84.11) в соответствии с критериями МКБ-10. С момента постановки диагноза пациент регулярно получал терапию нейролептиками и антидепрессантами с целью коррекции поведенческих нарушений и к моменту обращения принимал Хлорпротиксен в дозировке 45 мг/сут. На фоне медикаментозной терапии значимого улучшения не отмечалось, сохранялись выраженные нарушения поведения, проявляющиеся в виде агрессивных и аутоагрессивных реакций, импульсивности, эмоциональная нестабильность, грубые когнитивные и речевые нарушения. В возрасте 8 лет ребенок прошел МР-томографию головного мозга и электроэнцефалографию. По результатам МРТ-исследования значимых изменений выявлено не было, результаты электроэнцефалографии (ЭЭГ) свидетельствовали об отсутствии эпилептиформной активности.
До начала терапии КПК речевое развитие ребенка соответствовало общему недоразвитию речи 1 уровня с выраженным сенсорным компонентом, уровень интеллектуального развития соответствовал умеренной интеллектуальной недостаточности.
На момент обращения пациента за помощью в отделении детской психиатрии НМИЦ ПН им. В.М. Бехтерева проводилось научное исследование «Применение концентрата ядросодержащих клеток пуповинной крови у детей с состояниями выраженного когнитивного дефицита со снижением уровня контактности или аутистическими проявлениями» (протокол научного исследования был одобрен ЛЭК НМИЦ ПН им. В.М. Бехтерева 22.06.2017 г., утвержден на заседании ученого совета 28.06.2017 г., исследование проходило с сентября 2017 по июнь 2021 г.). Учитывая низкую эффективность стандартной терапии, а также соответствие критериям включения, родителям пациента было предложено участие в данном исследовании. После принятия положительного решения родители подписали добровольное информированное согласие на участие в данном исследовании, а также информированное согласие на публикацию клинического случая.
ХАРАКТЕРИСТИКИ ПРОДУКТА И ПРОЦЕДУРА ВВЕДЕНИЯ ПРЕПАРАТА
Образцы пуповинной крови забирали после пересечения пуповины по общепринятой методике в рамках безвозмездного донорства на основании добровольного информированного согласия, подписанного беременными, госпитализированными в национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова. В течение максимум 4 часов после забора образцы доставляли в лабораторию, где КПК выделяли по методике их подготовки для применения при онкогематологических заболеваниях в качестве альтернативы донорскому костному мозгу [20]. Концентрат КПК разливали в криопробирки и хранили в жидком азоте при температуре −196ºС. Образцы крови родильницы и пуповинной крови отправляли для исследования на стерильность и наличие гемотрансмиссивных инфекций в независимую лабораторию. Образцы пуповинной крови были проверены и признаны отрицательными в отношении вируса иммунодефицита человека (ВИЧ-1/2, антиген/антитела), вирусов гепатитов В (HBs Ag, anti-HBc-total) и С (anti-HCV-total), вируса Т-клеточного лейкоза (anti-HTLV-1/2), вирусов простого герпеса 1 и 2 типа (anti-HSV IgM), цитомегаловируса (anti-CMV IgM), возбудителей токсоплазмоза (anti-Toxo IgM), сифилиса (Syphilis RPR), бактериальных и грибковых агентов. Одновременно образцы характеризовались по AB0/Rh и содержанию клеток CD34 [21, 22].
Перед клиническим применением КПК в асептических условиях размораживали, отмывали от криопротектора, оценивали их жизнеспособность в тесте с трипановым синим и помещали в инфузионную среду. Готовый препарат представляет собой герметичный полимерный контейнер, содержащий 20 мл бледно-розовой опалесцирующей жидкости, содержащей суспензию 250±50 млн ядросодержащих клеток пуповинной крови в стерильном физиологическом растворе с добавлением реополиглюкина и человеческого сывороточного альбумина. Транспортировку размороженных и отмытых от криопротектора клеток в отделение осуществляли в термоконтейнере при температуре +1...+4°C (на льду). Время от момента размораживания концентрата до начала введения больному не превышало 2 ч. Пациенту проводилось внутривенное введение совместимого по группе крови и резус-фактору концентрата клеток пуповинной крови в дозе 250±20 млн клеток на одно введение. Всего было проведено 4 введения с интервалом в 14 дней. В соответствии с протоколом научного исследования перед началом введения КПК пациенту была проведена полная отмена медикаментозной терапии (к моменту обращения ребенок получал Хлорпротиксен в дозировке 45 мг/сут).
МЕТОДЫ ОЦЕНКИ ДИНАМИКИ СОСТОЯНИЯ
Для оценки когнитивных функций были использованы отдельные субтесты методики Векслера до начала терапии и через 6 и 12 месяцев. Для оценки динамики аутистических проявлений проводилось заполнение опросников Checklist for autism spectrum disorders (CASD) и Autism treatment evaluation checklist (ATEC) до начала терапии и через 6 месяцев. В методике CASD отмечается наличие или отсутствие 30 характерных симптомов, что позволяет дифференцировать аутизм от других нарушений развития. Данная методика способна выявлять детей с аутизмом с точностью 99,5% и предназначена для детей в возрасте от 1 до 16 лет [23]. ATEC представляет собой методику для оценки эффективности проводимого лечения при аутизме. Вопросы теста разделены на 4 группы: речь и коммуникативность, социализация, сенсорика и познавательные способности, здоровье и поведение [24].
Среди субтестов методики Векслера были выбраны «Повторение цифр», «Недостающие детали», «Кубики Коса» и «Шифровка». С помощью субтеста «Повторение цифр» оценивалась оперативная память и активное внимание, «Недостающие детали» использовались для оценки перцептивных способностей, наблюдательности и сосредоточенности, субтест «Кубики Коса» применялся для оценки аналитико-синтетических способностей, а субтест «Шифровка» помогал оценить характеристики внимания и развитие зрительно- моторной координации [25].
Инструментальный метод заключался в исследовании акустических стволовых вызванных потенциалов (АСВП) головного мозга до начала лечения и через 6 месяцев. Суть данного метода заключается в регистрации электрических откликов мозга на акустические стимулы. Метод использовался для выявления нарушений связи между органами слуха и головным мозгом и помогал оценивать функциональное состояние структур понтомедуллярного и понтомезэнцефального уровней мозга [26]. Также ребенку была проведена ЭЭГ до начала лечения и через 6 месяцев.
Оценка безопасности внутривенного введения суспензии КПК осуществлялась на основании шкалы степени тяжести нежелательного явления CTCAE (Common Terminology Criteria for Adverse Events) [27]. В соответствии с этой шкалой все нежелательные явления ранжируются на легкие, умеренные, выраженные, представляющие опасность для жизни и повлекшие за собой смерть.
РЕЗУЛЬТАТЫ ТЕРАПИИ
Введение КПК в дозировке 250±20 млн клеток характеризовалось хорошей переносимостью. У пациента на фоне терапии не было зафиксировано нежелательных явлений.
Динамика состояния по результатам психометрической и инструментальной оценки
До введения препарата КПК в силу выраженных нарушений коммуникации и эмоционально-поведенческих особенностей полное стандартное обследование по методике Векслера провести не удавалось. В связи с этим нами были выбраны отдельные субтесты методики, отражающие основные когнитивные функции. С помощью субтеста «Повторение цифр» оценивалась оперативная память и активное внимание, «Недостающие детали» использовались для оценки перцептивных способностей, наблюдательности и сосредоточенности, субтест «Кубики Коса» применялся для оценки аналитико-синтетических способностей, а субтест «Шифровка» помогал оценить характеристики внимания и развитие зрительно-моторной координации. Результаты тестирования представлены в табл. 1.
Таблица 1. Результаты отдельных субтестов методики Векслера до начала терапии, через 6 и 12 месяцев
|
Название субтеста |
До начала терапии |
Через 6 месяцев |
Через 12 месяцев |
|
Повторение цифр (внимание и память) |
1 (внимание – 0, память – 0) |
2 (внимание – 0, память – 2) |
1 (внимание – 0, память – 2) |
|
Недостающие детали (перцептивные способности, сосредоточенность) |
0 |
0 (инструкцию не понял) |
5 |
|
Кубики Коса (анализ-синтез со зрительным эталоном) |
4 |
5 |
8 |
|
Кодирование (зрительно-моторная координация, скорость формирования новых навыков) |
2 |
4 |
9 |
Примечание: 0 — не понял инструкцию; 5 баллов и выше — норма.
Как можно видеть из представленной таблицы, наблюдается значительное увеличение показателей субтестов «Недостающие детали», «Кубики Коса» и «Кодирование». Также необходимо отметить, что через 12 месяцев после первого введения КПК пациенту удалось провести полноценное тестирование по методике Векслера. Вербальный показатель интеллекта в формально-числовом выражении составил 42 балла, а невербальный — 79 баллов. Общий интеллектуальный показатель по тесту Векслера измерить не удалось из-за выраженного разброса показателей. Проведение тестирования стало возможным благодаря значительным улучшениям контактности, внимания и эмоционально-волевого контроля поведения пациента.
Анализ шкал CASD и ATEK также выявил выраженную положительную динамику (табл. 2 и 3). Общий балл по шкале CASD снизился с 16 баллов (до первого введения) до 6 баллов (через 6 месяцев после первого введения), общий балл по шкале АТЕС снизился с 80 баллов (до первого введения) до 16 баллов (через 6 месяцев после первого введения). По шкале АТЕС в разделе «Социализация» — снижение баллов с 27 до 3, «Здоровье/физическое развитие/поведение» — снижение баллов с 23 до 7, «Речь/язык/коммуникативные навыки» — снижение баллов с 18 до 5, «Сенсорные навыки/Познавательные способности» — снижение баллов с 12 до 1. По шкале CASD наибольшая положительная динамика отмечена в рубриках «Навязчивые действия (персеверации)» — снижение баллов с 4 (из 5) до 0, «Нарушения настроения» — снижение баллов с 2 (из 4) до 0.
Таблица 2. Динамика показателей опросника CASD до начала терапии и через 6 месяцев после
|
Разделы опросника CASD |
До начала терапии |
Через 6 месяцев |
|
«Проблемы с социальным взаимодействием» |
1 |
1 |
|
«Персеверации» |
4 |
0 |
|
«Соматосенсорные нарушения» |
2 |
1 |
|
«Отклонения в общении и развитии» |
5 |
4 |
|
«Нарушения настроения» |
2 |
0 |
|
«Проблемы с вниманием и осознанием опасности» |
2 |
0 |
|
Суммарный балл |
16 |
6 |
Таблица 3. Динамика показателей опросника ATEK до начала терапии и через 6 месяцев после
|
Разделы опросника ATEK |
До начала терапии |
Через 6 месяцев |
|
Речь/Язык/Коммуникативные навыки |
18 |
5 |
|
Социализация |
27 |
3 |
|
Сенсорные навыки/Познавательные способности |
12 |
1 |
|
Здоровье/Физическое развитие/Поведение |
23 |
7 |
|
Суммарный балл |
80 |
16 |
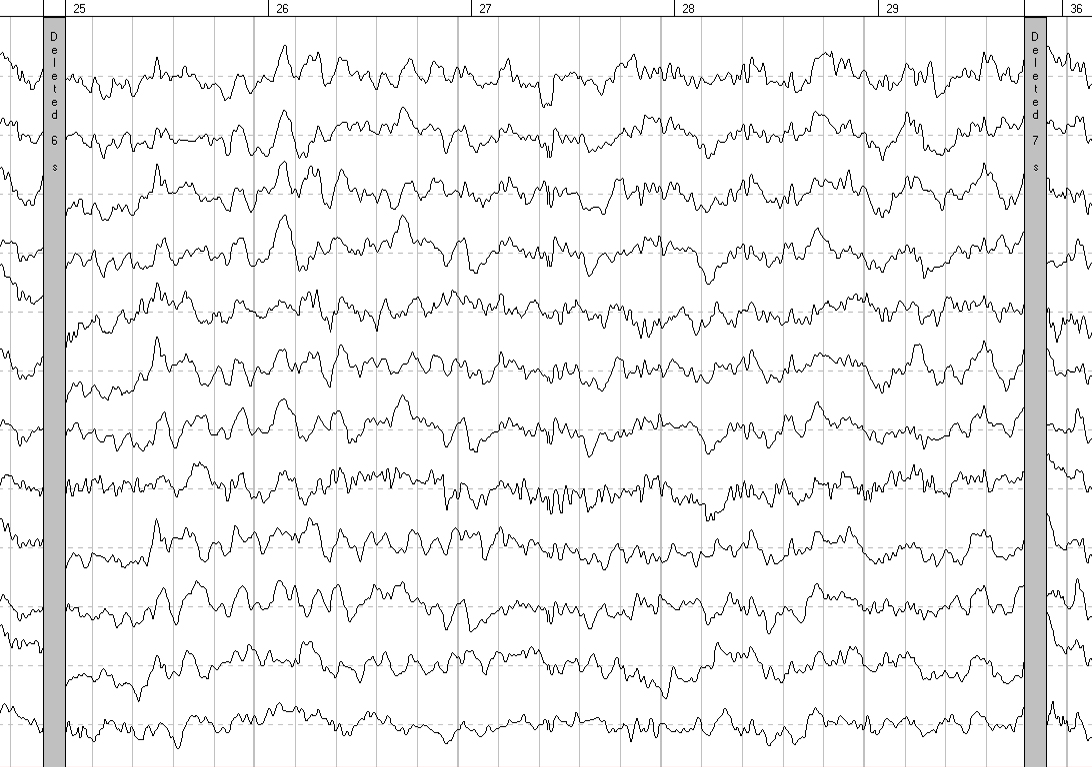
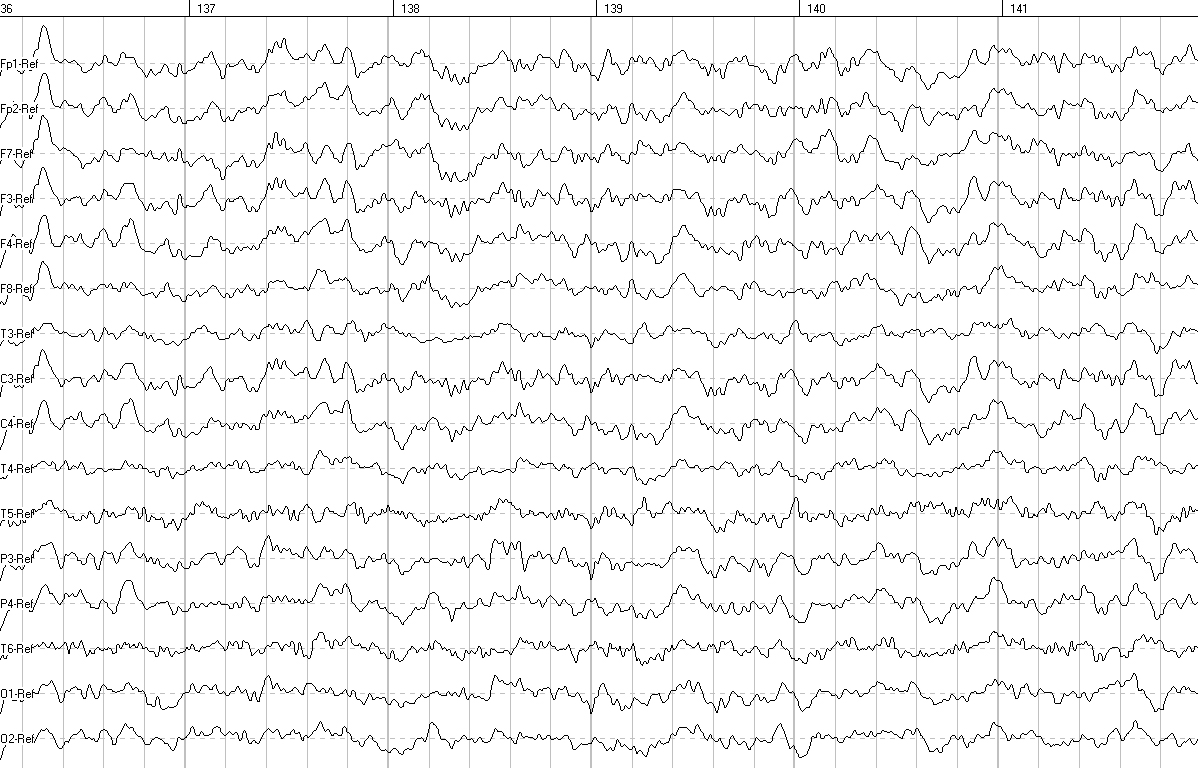
Анализ ЭЭГ заключался в оценке общего функционального состояния мозга, уровня зрелости биоэлектрической активности, тяжести изменений ЭЭГ и уточнении локализации патологических изменений и показал выраженную положительную динамику показателей через 6 месяцев после введения КПК (рис. 1, 2). Анализ результатов АСВП показал, что через 6 месяцев после введения КПК улучшилось проведение акустического сигнала на участке «слуховой нерв-оливарный комплекс» слева (интервал I–III — 2,57 мс до начала терапии и 2,35 мс через 6 месяцев).
Рис. 1. ЭЭГ до начала терапии.
Рис. 2. ЭЭГ через 6 месяцев после начала терапии.
В ЭЭГ, проведенной через 6 месяцев после начала терапии, отмечается увеличение количества групп α-волн, снижение амплитуды фоновой ЭЭГ, уменьшение количества полифазных потенциалов в затылочных отведениях обоих полушарий, уменьшение волн медленноволнового спектра (θ-волн, единичных σ-волн). Также обнаружено значимое снижение амплитудных характеристик и формирование зональности в виде выраженного нарастания амплитуды по направлению от фронтальных отделов коры к затылочным, чего не наблюдалось до начала терапии. При сравнении данных количественной ЭЭГ на фоне закрытых глаз отмечается: увеличение мощности волн α-диапазона в теменных и затылочных отведениях обоих полушарий, уменьшение мощности волн θ-диапазона в затылочно-теменных отведениях обоих полушарий. Анализ реорганизации ведущего электроэнцефалографического паттерна в динамике свидетельствует о снижении выраженности функциональной незрелости структур головного мозга у пациента после лечения.
Динамика состояния в результате клинической оценки
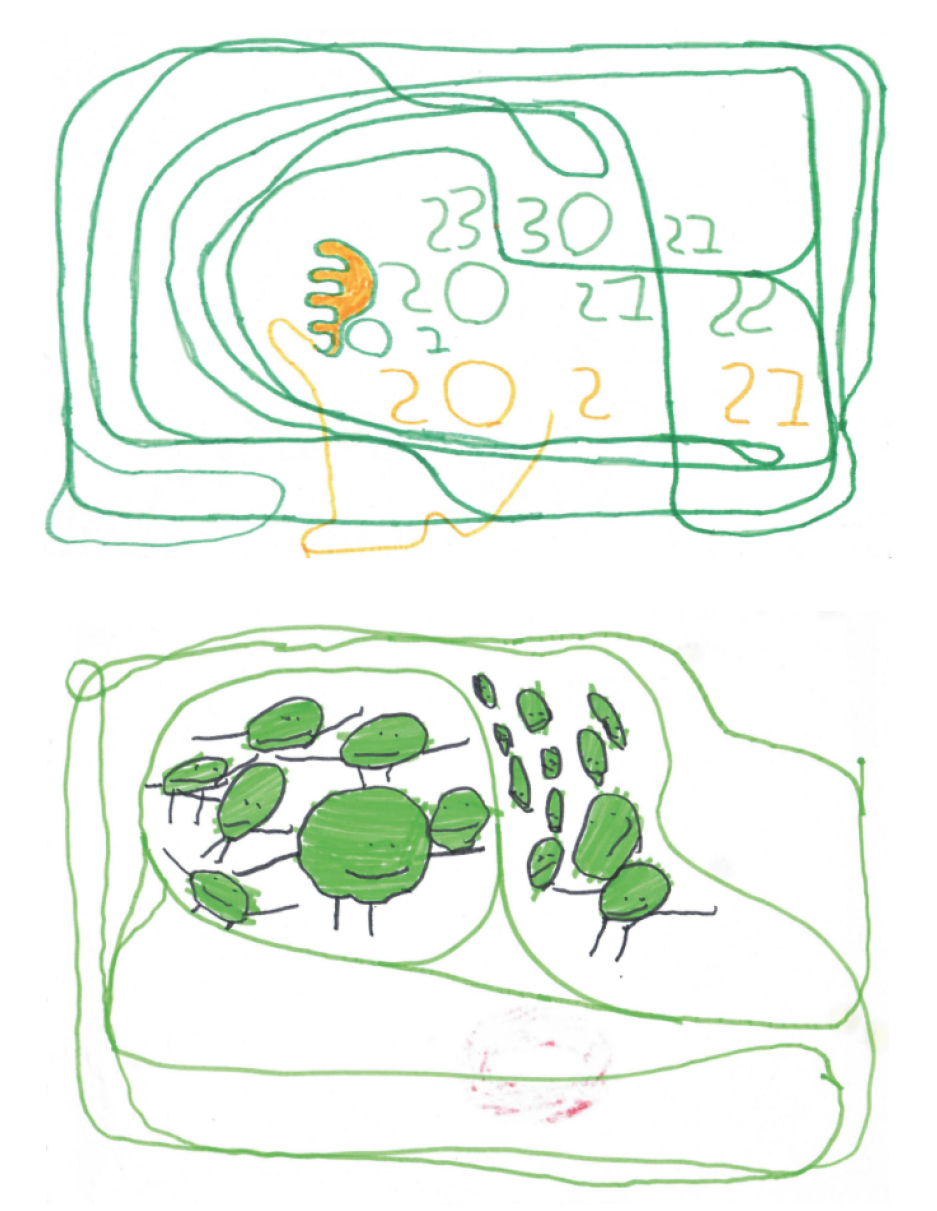
Через несколько месяцев после начала терапии у ребенка значительно расширился словарный запас, появилась простая фраза, речь стала носить коммуникативную направленность. Но наиболее заметный результат был отмечен в эмоциональной сфере и поведении — ребенок стал значительно спокойнее, пропала агрессия и аффективные вспышки, что позволило полностью отменить нейролептическую терапию. Скачок в развитии когнитивных функций отразился на изобразительной деятельности ребенка (рис. 3, 4). До терапии рисунки пациента были однообразными и носили беспредметный характер. Благодаря развитию внимания, восприятия и мелкой моторики у ребенка начали формироваться навыки чтения и письма.
Рис. 3. Рисунки пациента до начала лечения.
Рис. 4. Рисунки пациента через 6-9 месяцев.
ОБСУЖДЕНИЕ
Последние десятилетия отмечается значительное увеличение исследовательских работ, посвященных применению стволовых клеток для лечения неврологических и психических расстройств. Среди них имеется немало описаний отдельных клинических случаев, при которых клеточная терапия дала действительно прорывной результат [28–32].
На наш взгляд, описанный нами случай тоже можно отнести к таковым. Несмотря на большое количество работ, ранее не было описано ни одного успешного клинического случая терапии КПК в отношении регрессивных форм аутизма, хотя имеется достаточное количество данных о влиянии нейровоспаления на развитие регрессивного аутизма, так же как и о иммуномодулирующей функции стволовых клеток. Для пациентов с регрессивным аутизмом характерны иммунные нарушения, повышение выработки провоспалительных цитокинов, нарушения гематоэнцефалического барьера и подострое воспаление в ткани мозга [33]. Провоспалительные цитокины, проникая через гемато-энцефалический барьер, влияют на микроглию и астроглию, что приводит к нарушению прунинга и синаптической передачи [34]. Микроанатомически у пациентов с аутизмом наблюдается уменьшение длины дендритов (особенно в лобной, височной и моторной коре), увеличение числа корковых колонок при уменьшении их объема, размытые границы серого и белого вещества [35, 36]. Провоспалительный иммунный статус таких пациентов обуславливает склонность к неадекватному ответу иммунной системы на провоцирующие факторы (инфекции, иммунизация) и выработке аутоантител к собственным тканям, что нередко приводит к регрессу приобретенных ранее навыков и нарастанию аутистической симптоматики [37, 38]. Как подтверждение можно встретить исследования по успешному применению противовоспалительной терапии для лечения регрессивного аутизма [39, 40]. Многочисленные исследования показали, что стволовые клетки (СК) обладают иммуномодулирующим эффектом, заключающимся в подавлении активности факторов врожденного иммунитета (дендритных клеток, естественных киллеров, комплемента), функций цитотоксических Т-лимфоцитов и Т-хелперов. Кроме того, СК транслируют свои функции другим клеткам, в частности регуляторным Т-лимфоцитам, что определяет эффективность клеточной терапии даже после лизиса введенных стволовых клеток [41–43]. Указание на регресс и развитие заболевания после двух лет на фоне инфекционного заболевания позволяет предположить наличие у нашего пациента регрессивной формы аутизма, для которой в наибольшей степени характерны иммунные нарушения [33]. Это предположение позволяет объяснить выраженную положительную динамику у фармакорезистентного пациента на фоне терапии КПК. Однако, необходимо отметить, что описанный случай является на сегодняшний день единственным, и для подтверждения гипотезы необходимо проведение расширенных клинических исследований на большой выборке пациентов с регрессивными формами аутизма, а также проведение иммунобиохимических исследований, подтверждающих аномальный иммунный статус пациентов.
ЗАКЛЮЧЕНИЕ
Применение клеток пуповинной крови характеризуется хорошей переносимостью, отсутствием существенных нежелательных побочных явлений. Применение ядросодержащих КПК у пациента с регрессивным аутизмом привело к значительному улучшению когнитивных функций и снижению выраженности аутистических симптомов. Выявлена положительная динамика в виде развития восприятия, снижения соматосенсорных нарушений, нормализации эмоционального статуса, развития социализации и коммуникативных способностей. Полная отмена нейролептической терапии также является важным позитивным результатом проведенного лечения. Описанный случай служит доказательством того, что применение КПК при некоторых формах аутизма у детей может привести к значительному улучшению состояния.
Литература
- Iles A. Autism Spectrum Disorders. Prim Care. 2021 Sep;48(3):461-73. doi: 10.1016/j.pop.2021.04.003.
- Yin J, Schaaf CP. Autism genetics — an overview. PrenatDiagn. 2017;37(1):14-30. doi: 10.1002/pd.4942.
- Bhandari R, Paliwal JK, Kuhad A. Neuropsychopathology of autism spectrum disorder: complex interplay of genetic, epigenetic, and environmental factors. Adv Neurobiol. 2020;24:97–141. doi: 10.1007/978-3-030-30402-7_4.
- Thapar A, Rutter M. Genetic advances in autism. J Autism Dev Disord. 2021;51(12):4321–32. doi: 10.1007/s10803-020-04685-z.
- Goel R, Hong JS, Findling RL, Ji NY. An update on pharmacotherapy of autism spectrum disorder in children and adolescents. Int Rev Psychiatry. 2018;30(1):78–95. doi: 10.1080/09540261.2018.1458706.
- Persico AM, Ricciardello A, Cucinotta F. The psychopharmacology of autism spectrum disorder and Rett syndrome. Handbook of clinical neurology. 2019;165:391–414. doi: 10.1016/B978-0-444-64012-3.00024-1.
- Shmakova OP. Structural and dynamic features of early disability due to mental diseases. Pulse. 2020;22(10):62–7 (2020). doi: 10.26787/nydha-2686-6838-2020-22-10-62-67. Russian.
- Donegan JJ, Lodge DJ. Stem cells for improving the treatment of neurodevelopmental disorders. Stem Cells Dev. 2020;29(17):1118–30. doi: 10.1089/scd.2019.0265.
- Larijani B, ParhizkarRoudsari P, Hadavandkhani M, Alavi-Moghadam S, Rezaei-Tavirani M, Goodarzi P, Sayahpour FA, Mohamadi-Jahani F, Arjmand B. Stem cell-based models and therapies: a key approach into schizophrenia treatment. Cell Tissue Bank. 2021;22(2):207–23. doi: 10.1007/s10561-020-09888-3.
- Sun JM, Song AW, Case LE, Mikati MA, Gustafson KE, Simmons R, Goldstein R, Petry J, McLaughlin C, Waters-Pick B, Chen LW, Wease S, Blackwell B, Worley G, Troy J, Kurtzberg J. Effect of autologous cord blood infusion on motor function and brain connectivity in young children with cerebral palsy: a randomized, placebo-controlled trial. Stem Cells Trans Med. 2017;6(12):2071–8. doi: 10.1002/sctm.17-0102.
- Romanov YA, Tarakanov OP, Radaev SM, Dugina TN, Ryaskina SS, Darevskaya AN, Morozova YV, Khachatryan WA, Lebedev KE, Zotova NS, Burkova AS, Sukhikh GT, Smirnov VN. Human allogeneic AB0/Rh-identical umbilical cord blood cells in the treatment of juvenile patients with cerebral palsy. Cytotherapy. 2015;17(7):969–78. doi: 10.1016/j.jcyt.2015.02.010.
- Surugiu R, Olaru A, Hermann DM, Glavan D, Catalin B, Popa-Wagner A. Recent advances in mono- and combined stem cell therapies of stroke in animal models and humans. Int J Mol Sci. 2019;20(23):6029. doi: 10.3390/ijms20236029.
- Peng X, Song J, Li B, Zhu C, Wang X. Umbilical cord blood stem cell therapy in premature brain injury: Opportunities and challenges. J Neurosci Res. 2020;98(5):815-825. doi: 10.1002/jnr.24548.
- Wang SM, Lee CU, Lim HK. Stem cell therapies for Alzheimer’s disease: is it time? Curr Opin Psychiatry. 2019;32(2):105–16. doi: 10.1097/YCO.0000000000000478.
- Ternovoy S, Ustyuzhanin D, Morozova Y, Shariya M, Roldan-Valadez E, Smirnov V. Functional MRI evince the safety and efficacy of umbilical cord blood cells therapy in patients with schizophrenia. Schizophr Res. 2020;224:175–7. doi: 10.1016/j.schres.2020.09.028.
- Morozova YV, Radaev SM, Voronova EI, Emelina DA. Umbilical cord blood cells in the treatment of patients with schizophrenia in remission. Genes & Cells. 2021;16(1):75–81. doi: 10.23868/202104012. Russian.
- Lv YT, Zhang Y, Liu M, Qiuwaxi JN, Ashwood P, Cho SC, Huan Y, Ge RC, Chen XW, Wang ZJ, Kim BJ, Hu X. Transplantation of human cord blood mononuclear cells and umbilical cord-derived mesenchymal stem cells in autism. J Transl Med. 2013;11:196. doi: 10.1186/1479-5876-11-196.
- Murias M, Major S, Compton S, Buttinger J, Sun JM, Kurtzberg J, Dawson G. Electrophysiological biomarkers predict clinical improvement in an ppen-label trial assessing efficacy of autologous umbilical cord blood for treatment of autism. Stem Cells Transl Med. 2018;7(11):783-791. doi: 10.1002/sctm.18-0090.
- Chez M, Lepage C, Parise C, Dang-Chu A, Hankins A, Carroll M. Safety and observations from a placebo-controlled, crossover study to assess use of autologous umbilical cord blood stem cells to improve symptoms in children with autism. Stem Cells Transl Med. 2018;7(4):333-341. doi: 10.1002/sctm.17-0042.
- Rubinstein P, Dobrila L, Rosenfield RE, Adamson JW, Migliaccio G, Migliaccio AR, Taylor PE, Stevens CE. Processing and cryopreservation of placental/umbilical cord blood for unrelated bone marrow reconstitution. Proc Natl Acad Sci USA. 1995 Oct 24;92(22):10119-22. doi: 10.1073/pnas.92.22.10119.
- Sutherland DR, Anderson L, Keeney M, Nayar R, Chin-Yee I. The ISHAGE guidelines for CD34+ cell determination by flow cytometry. International Society of Hematotherapy and Graft Engineering. J Hematother. 1996 Jun;5(3):213-26. doi: 10.1089/scd.1.1996.5.213.
- Pranke P, Hendrikx J, Alespeiti G, Nardi N, Rubinstein P, Visser J. Comparative quantification of umbilical cord blood CD34+ and CD34+ bright cells using the ProCount-BD and ISHAGE protocols. Braz J Med Biol Res. 2006;39(7):901–6. doi: 10.1590/s0100-879x2006000700008.
- Mayes SD. Brief report: checklist for autism spectrum disorder: most discriminating items for diagnosing autism. J Autism Dev Disord. 2018;48(3):935–9. doi: 10.1007/s10803-017-3401-0.
- Mahapatra S, Vyshedsky D, Martinez S, Kannel B, Braverman J, Edelson SM, Vyshedskiy A. Autism Treatment Evaluation Checklist (ATEC) norms: a “Growth Chart” for ATEC score changes as a function of age. Children (Basel). 2018;5(2):25. doi: 10.3390/children5020025.
- Panasyuk AY. [Adapted version of D. Wexler’s method (WISC)]. Moscow: Institute of Hygiene for Children and Adolescents of the Ministry of Health of the USSR; 1973. p. 80. Russian.
- Eggermont JJ. Auditory brainstem response. Handb Clin Neurol. 2019;160:451–64. doi: 10.1016/B978-0-444-64032-1.00030-8.
- Maric DM, Papic V, Radomir M, Stanojevic I, Sokolovac I, Milosavljevic K, Maric DL, Abazovic D. Autism treatment with stem cells: a case report. Eur Rev Med Pharmacol Sci. 2020;24(15):8075–80. doi: 10.26355/eurrev_202008_22491.
- Shroff G. Human embryonic stem cells in the treatment of autism: a case series. InnovClinNeurosci. 2017;14(3-4):12–6.
- Kobinia GS, Zaknun JJ, Pabinger C, Laky B. Case report: autologous bone marrow derived intrathecal stem cell transplant for autistic children - a report of four cases and literature review. Front Pediatr. 2021;9:620188. doi: 10.3389/fped.2021.620188.
- Okur SÇ, Erdoğan S, Demir CS, Günel G, Karaöz E. The effect of umbilical cord-derived mesenchymal stem cell transplantation in a patient with cerebral palsy: a case report. Int J Stem Cells. 2018;11(1):141–7. doi: 10.15283/ijsc17077.
- Zhang C, Huang L, Gu J, Zhou X. Therapy for cerebral palsy by human umbilical cord blood mesenchymal stem cells transplantation combined with basic rehabilitation treatment: a case report. Glob Pediatr Health. 2015;2:2333794X15574091. doi: 10.1177/2333794X15574091.
- Prosperi M, Guiducci L, Peroni DG, Narducci C, Gaggini M, Calderoni S, Tancredi R, Morales MA, Gastaldelli A, Muratori F, Santocchi E. Inflammatory biomarkers are correlated with some forms of regressive autism spectrum disorder. Brain Sci. 2019;9(12):366. doi: 10.3390/brainsci9120366.
- Liberman AC, Trias E, da Silva Chagas L, Trindade P, Dos Santos Pereira M, Refojo D, Hedin-Pereira C, Serfaty CA. Neuroimmune and inflammatory signals in complex disorders of the central nervous system. Neuroimmunomodulation. 2018;25(5-6):246–70. doi: 10.1159/000494761.
- Prem S, Millonig JH, DiCicco-Bloom E. Dysregulation of neurite outgrowth and cell migration in autism and other neurodevelopmental disorders. AdvNeurobiol. 2020;25:109–53. doi: 10.1007/978-3-030-45493-7_5.
- Donovan AP, Basson MA. The neuroanatomy of autism — a developmental perspective. J Anat. 2017;230(1):4–15. doi: 10.1111/joa.12542.
- Tamouza R, Fernell E, Eriksson MA, Anderlid BM, Manier C, Mariaselvam CM, Boukouaci W, Leboyer M, Gillberg C. HLA Polymorphism in regressive and non-regressive autism: a preliminary study. Autism Res. 2020;13(2):182-186. doi: 10.1002/aur.2217.
- Enstrom A, Onore C, Tarver A, Hertz-Picciotto I, Hansen R, Croen L, Van de Water J, Ashwood P. Peripheral blood leukocyte production of BDNF following mitogen stimulation in early onset and regressive autism. Am J BiochemBiotechnol. 2008;4(2):121–29. doi: 10.3844/ajbbsp.2008.121.129.
- Malek M, Ashraf-Ganjouei A, Moradi K, Bagheri S, Mohammadi MR, Akhondzadeh S. Prednisolone as adjunctive treatment to risperidone in children with regressive type of autism spectrum disorder: a randomized, placebo-controlled trial. ClinNeuropharmacol. 2020;43(2):39–45. doi: 10.1097/WNF.0000000000000382.
- Golla S, Sweeney JA. Corticosteroid therapy in regressive autism: preliminary findings from a retrospective study. BMC Med. 2014;12:79. doi: 10.1186/1741-7015-12-79.
- Jiang W, Xu J. Immune modulation by mesenchymal stem cells. Cell Prolif. 2020;53(1):e12712. doi: 10.1111/cpr.12712.
- Luque-Campos N, Contreras-López RA, Jose Paredes-Martínez M, Torres MJ, Bahraoui S, Wei M, Espinoza F, Djouad F, Elizondo-Vega RJ, Luz-Crawford P. Mesenchymal stem cells improve rheumatoid arthritis progression by controlling memory T cell response. Front Immunol. 2019;10:798. doi: 10.3389/fimmu.2019.00798.
- Damien P, Allan DS. Regenerative therapy and immune modulation using umbilical cord blood-derived cells. Biol Blood Marrow Transplant. 2015;21(9):1545–54. doi: 10.1016/j.bbmt.2015.05.022.
Информация об авторах
Метрики
Просмотров
Всего: 83
В прошлом месяце: 21
В текущем месяце: 29
Скачиваний
Всего: 12
В прошлом месяце: 6
В текущем месяце: 3