Введение
Вариабельность сердечного ритма (ВСР) - это изменчивость временных расстояний между соседними циклами сердечных сокращений (RR-интервалов).
Современные теории, описывающие природу ВСР, такие, например, как модель нейровисцеральной интеграции (Thayer, Lane, 2012), двухконтурная модель нервно-гуморальной регуляции сердечного ритма (Баевский, 2004), поливагальная теория (Porges, 2009), строятся на изначальных идеях К. Бернарда (конец XIX в.) о нейрокардиальных связях и развивают их, лишь уточняя границы структур мозга, изменения активности которых сопровождаются изменениями сердечного ритма. В основе данных концепций лежит положение о том, что нервная система управляет активностью сердца (или регулирует ее) в соответствии с запросами внешней среды. В таком подходе ВСР как феномен является результатом циклических модуляций со стороны регуляторных центров продолговатого и промежуточного мозга, различных отделов коры. Эти модуляции вносятся в активность синоатриального узла сердца посредством передачи эфферентных сигналов через нервные пути парасимпатического и симпатического отделов вегетативной нервной системы. ВСР, таким образом, является результатом нервного управления активностью сердца.
В результате многочисленных исследований, выполненных в рамках описанных концепций, была сформулирована система физиолого-медицинских интерпретаций ВСР (Malik et al., 1996; von Borell et al., 2007). В первом случае интерпретация ВСР проводится в терминах функциональных состояний как специфических режимов энергообеспечения организма. В данном случае на основании параметров ВСР определяется статус организма по шкале (разного уровня сложности: от линейных до трехмерных) адаптивности (боль- шая/меньшая адаптивность или более/менее ресурсозатратный режим) (Баевский, 2004; Машин, 2011). Второй вариант, являющийся логическим предшественником первого, предоставляет описание относительной активности отдельных физиологических структур, участвующих в управлении/регуляции сердечного ритма, а именно парасимпатического и симпатического отделов вегетативной нервной системы (Баевский, 2004; Рунова и др., 2013; Borell et al., 2007). Так, применяя спектральный анализ, вычисляются мощность низкочастотных колебаний ВСР (НЧ, 0,04-0,15 Гц), которая интерпретируется как активность симпатической нервной системы, и мощность высокочастотных колебаний ВСР (ВЧ, 0,150,6 Гц), которая интерпретируется как активность парасимпатической нервной системы; коэффициент НЧ/ВЧ отражает соотношение симпатических и парасимпатических воздействий на сердце. При этом динамика ВСР рассматривается как сумма этих воздействий.
Данные интерпретации являются предметом активной научной дискуссии, поскольку исследователями был накоплен целый ряд противоречащих им эмпирических данных (подробнее см. обзоры: Billman, 2013; Reyes del Paso et al., 2013). Кроме того, существенным недостатком обсуждаемых концепций является специфика эмпирической базы - в их основе лежат результаты экспериментов, проведенных на животных - наркотизированных или обездвиженных (Курьянова, 2010; Lombardi et al., 1990), с участием человека, находящегося в покое (лежа или сидя, с закрытыми глазами) (Баевский, 2004; Malik et al., 1996), т. е. условия данных экспериментов исключают поведенческую активность субъекта исследования. Следовательно, невозможно экстраполировать результаты такого рода экспериментов и полученные в них закономерности на реальную поведенческую активность субъекта.
Разрешение приведенных противоречий представляется возможным в рамках системно-эволюционного подхода (Швырков, 1995) с построением системного описания механизмов поведения в связи с ВСР. Именно в рамках теории функциональных систем и сформированного на ее основе системно-эволюционного подхода разработано представление об общеорганизменных системах, в которых согласуется активность нейронов и элементов, принадлежащих к самым разным органам и тканям организма. Это согласование, устанавливающееся в актах научения, в процессе которых осуществляется, в частности, «пригонка ... вегетативного компонента к задаче» формируемого поведения (Анохин, 1968, с. 361), и обеспечивает достижение результатов в целостном взаимодействии индивида и среды. В таком случае классические представления о природе ВСР (приведенные выше) требуют существенного пересмотра в связи с лежащей в их основе антисистемностью «управленческой» и «регуляторной» терминологии, на которую указывал еще П.К. Анохин: «. выражение “управляющая система” (УС) ... ни семантически, ни логически не может быть принято теорией функциональных систем. <...> Что означает это выражение? Ничего, кроме традиционного игнорирования результата системы при обсуждении кибернетических закономерностей. Выражение “УС” ... предполагает, что управляемый объект не является компонентом “УС”, т. е. ... находится за пределами самой “УС”» (1973, с. 36).
Ранее другой отечественный физиолог В.Н. Черниговский также провел анализ механизмов включенности внутренних органов в общеорганизменные процессы, основываясь на теории функциональных систем (Черниговский, 1975). В.Н. Черниговский полагал, что поведение висцеральных «систем» в организме (их саморегуляция), обусловленное реализацией генетически детерминированной программы, находится в согласовании с высшими отделами нервной системы. Тогда поведение висцеральных «систем» можно определить как процесс оптимизации всех внутренних перестроек организма (изменения в активности внутренних органов) в соответствии с текущими задачами взаимодействия субъекта со средой. В данном случае ВСР рассматривается как индикатор оптимизации активности сердца в соответствии с результатами реализуемого поведения, т. е. проявлением процесса взаимоСОдействия элементов функциональной системы (по П.К. Анохину).
Системная организация поведения. Системно-эволюционный подход рассматривает физиологическое и психическое как разные аспекты описания единых системных процессов - актуализации в поведении взаимодействующих функциональных систем, составляющих структуру индивидуального опыта (Александров, 2009). С этих позиций, как уже отмечалось, функциональные системы рассматриваются не только как «мозговые», но и как общеорганизменные, т. е. подразумевается, что клетки разных тканей, а не только нейроны, проявляют активность и взаимосодействуют в системах, направленных на достижение пусть и различных, но единых для целостного организма результатов. Следовательно, не только характеристики активности нейронов, но также и характеристики клеток «тела» непосредственно связаны с особенностями реализуемых в поведении функциональных систем. Так, П.К. Анохин, подробно описывая специфику работы дыхательного компонента поведенческой активности, его взаимосодействие с другими физиологическими компонентами и подстройку к особенностям того или иного поведения, заключает: «дыхательный компонент ... не может не быть специфичным для каждого отдельного состояния животного» (Анохин, 1968, с. 361; курсив П.К. Анохина).
Реализация конкретного поведенческого акта обеспечивается активностью набора функциональных систем в их взаимодействии. Функциональная система (ФС) как элемент структуры индивидуального опыта фиксируется в специализации группы нейронов. Фиксация новой ФС в процессе научения не вытесняет ФС из уже имеющегося набора, а модифицирует их. Развитие индивида проявляется в структуре индивидуального опыта как формирование новых ФС, обеспечивающих более дифференцированные взаимодействия индивида со средой, чем ранее сформированные ФС (Александров, 2009; Швырков, 1995).
Исходя из системных представлений об организации поведения, можно полагать, что сердце, включаясь в обеспечение поведенческих актов, направленных на достижение разных результатов, согласует свою активность с другими элементами организма, образуя, таким образом, ФС. Поэтому активность сердца, согласуясь, в частности, с активностью центральных и периферических нейронов, как мы полагаем, непосредственно взаимосвязана с целью поведения. Тогда ВСР является результатом процесса согласования активности различных элементов организма и зависит от базовых характеристик системной организации реализуемого поведения, в том числе от степени дифференцированности актуализированного набора систем, т. е. от соотношения «старых» (приобретенных относительно давно в онтогенезе) и «новых» (приобретенных относительно недавно) систем в актуализированном наборе. Так, поведение, сформированное на более поздних этапах развития, является, как правило, более дифференцированным соотношением организма и среды и обеспечивается набором систем сравнительно более высокой дифференциации (Александров, 2009; Чуприкова, 1997).
Системная дедифференциация - это обратимое увеличение вклада ранее сформированных систем в обеспечение поведения (Александров, 2016). Дедифференциация характеризуется такими аспектами поведения, как повышение эмоциональности, упрощение, игнорирование деталей, снижение когнитивного контроля и пр. (Александров, 2016). Мы полагаем, что временная системная дедифференциация сопровождается редукцией ВСР, так как уменьшается и количество актуализированных в поведении систем, и количество межсистемных связей - как вертикальных (между системами разного возраста), так и горизонтальных (между системами, принадлежащими к одному периоду развития).
Сложность сердечного ритма. Вместо классических статистических или спектральных показателей ВСР, о которых говорилось выше, мы предлагаем использовать методы нелинейной динамики, а именно - оценку сложности ВСР.
Понятия сложности и энтропии являются базовыми в теории информации. А.Н. Колмогоров дал алгоритмическое определение понятию сложности: «“относительной сложностью” (или энтропией) объекта y при заданном x является минимальная длина “программы” p получения y из x» (Колмогоров, 1965). Такое определение стало универсальным определением сложности и позволило применять эти понятия к описанию «индивидуальных (конечных) объектов» (Колмогоров, 1969; Звонкин, Левин, 1970). Во многом поэтому понятие сложности, преобразованное в понятие «сложность сигнала», смогло перейти из математики в биологию, электрофизиологию (Дарховский и др., 2002; Richman, Moorman, 2(0^0) и психофизиологию (Крылов, 2014). В этих областях методы нелинейной динамики стали представляться как наиболее подходящие для изучения и понимания биологических «систем».
Относительно неравномерных временных рядов, какими являются последовательности RR-интервалов, энтропийные способы определения сложности последовательности стали применяться и развиваться с 1991 г. - после определения аппроксимированной энтропии (Pincus, 1991). Аппроксимированная энтропия (ApEn) является характеристикой «внутреннего порядка» временной последовательности RR-интервалов (Гудков, 2009; Acharya et. al., 2006). Математически ApEn отражает вероятность обнаружения в последовательности двух соседних векторов, отличающихся при переходе из пространства размерностью m в пространство размерностью m+1. Иначе говоря, ApEn последовательности тем выше, чем больше в ней присутствуют неодинаковые изменения.
Наиболее существенными для психофизиологических исследований преимуществами ApEn (по сравнению с другими методами нелинейной динамики) являются следующие ее характеристики: 1) ApEn выражает степень сложности сигнала, т. е. чем выше регулярность сигнала, тем ниже величина ApEn (ниже сложность) и наоборот; 2) алгоритм вычисления ApEn нечувствителен к кратковременным, локальным шумам в сигнале; 3) ApEn позволяет получать надежные оценки, используя короткие последовательности данных; 4) ApEn не коррелирует с выраженностью дыхательной аритмии в сердечном ритме и со стандартным отклонением и спектральными показателями анализируемой последовательности, т. е. является относительно независимым показателем (Манило, Зозуля, 2007; Pincus, 1991; Acharya et al., 2006; Seely, Maclem, 2004).
Предлагаемое ниже исследование направлено на проверку гипотезы о том, что временная системная дедифференциация, т. е. сдвиг системной организации поведения в сторону повышения «веса» функциональных систем, сформированных на более ранних этапах развития, будет сопровождаться изменениями в активности сердца в сторону снижения сложности динамики сердечного ритма.
Программа исследования
Было проведено две экспериментальные серии с формированием условий временной дедифференциации состояния субъекта поведения: стресс и введение алкоголя.
Первая экспериментальная серия. Стресс является одним из состояний, в которых наблюдается временная системная дедифференция (Александров, 2016). Это обосновано тем, что в исследованиях стресса показаны такие характерные для этого состояния аспекты, как: повышенная эмоциональность, игнорирование деталей (Schwabe et al., 2011), проявление более привычных стратегий поведения (Schwabe, Walrf, 2009), проявление более онтогенетически ранних форм поведения в ситуации «морального выбора», регрессия (Знаменская и др., 2016), переход от аналитических (рациональных) к интуитивным обоснованиям при принятии решений (Yu, 2016), переход к более эволюционно старым механизмам поведения (Парин и др., 2007). Кроме того, прямые нейрогистохимические эксперименты показали понижение уровня активации нейронов (по экспрессии гена c-fos) корковых (но не подкорковых) структур в ситуации стресс-индуцированного научения (Булава, Гринченко, 2016).
В качестве экспериментальной модели стресса использовалось значимое для участников эксперимента публичное выступление (как часть признанной модели Trier Social Stress Test (Childs et al., 2006)), а именно проводилась регистрация сердечного ритма у студентов и аспирантов при защите квалификационных работ (22 человека, 11 мужчин, возраст от 19 до 30 лет, M = 24,14, SD = 3,48, Med = 24). Все испытуемые дали информированное письменное согласие на участие в исследовании.
Беспроводная регистрация сердечного ритма проводилась с использованием датчика Zephyr (HxM BT) и программы «HR-reader» (Полевая и др., 2012). Фиксировались моменты начала и окончания выступления. Характеристики сердечного ритма оценивались за период 5 мин до начала выступления и в течение собственно выступления.
Вторая экспериментальная серия. Введение алкоголя можно использовать как экспериментальное условие временной дедифференциации состояния субъекта поведения, так как алкоголь оказывает угнетающее влияние на активность более «новых» элементов индивидуального опыта (Alexandrov et al., 1993), а именно относительное количество нейронов, фиксирующих такие элементы при обучении индивида инструментальному поведению, уменьшается (Александров и др., 1990). Это может проявляться в трудностях при обучении новому поведению и автоматизации приобретенного навыка (Безденежных, Александров, 2014) или в снижении мозгового обеспечения выполнения задачи категоризации слов (в большей степени при использовании позднее усвоенного иностранного по сравнению с ранее приобретенным родным языком (Alexandrov et al., 1998)).
Введение алкоголя производилось следующим образом: у участников исследования, которых заранее информировали о необходимости не употреблять алкоголь минимум за сутки до эксперимента, измеряли массу тела (кг) и концентрацию алкоголя в выдыхаемом воздухе (BrAC - breath alcohol content, мг/л, алкотестер: AlcoDigital AL7000 Pro Breathalyzer). Далее участники в течение 30 мин выпивали два стакана с алкогольным (экспериментальная группа) или безалкогольным (контрольная группа) напитком при просмотре фильма, выбранного из серии «БиБиСи Планета Земля» (длительность фильмов 40-45 мин). Затем вновь проводилось измерение BrAC. Этанол применялся в дозе 1 г/кг массы тела. В исследовании был использован медицинский спирт, »96% этанола. Расчет объема спирта (мл) проводился умножением веса испытуемого на коэффициент 1,3. Средний уровень алкоголя BrAC в конце эксперимента в экспериментальной группе составлял 0,72±0,11 мг/л. Спирт смешивали с фруктовым соком, итоговый объем всегда составлял 750 мл. В контрольной группе сок смешивали с водой в тех же пропорциях.
В ходе всего времени эксперимента производилась запись сердечного ритма с использованием датчика Zephyr (HxM BT) и программы «HR-reader» Характеристики сердечного ритма сравнивались за периоды 10, 20, 30, 40 минут от начала приема напитка.
В эксперименте приняли участие 37 человек: экспериментальная группа - 19 человек (15 мужчин, возраст от 22 до 36 лет, M = 26,68, SD = 3,88, Med = 26), контрольная группа - 18 человек (14 мужчин, возраст от 22 до 34 лет, M = 25,56, SD = 3,57, Med = 25). Все участники исследования подписали письменное информированное согласие.
Вычисление аппроксимированной энтропии для анализируемых последовательностей RR-интервалов (длина последовательностей N = 300) производилось по стандартному алгоритму (Pincus, 1991) с входными параметрами: m = 2 (размерность вложения), r = 0,5*6 («фильтрующий фактор»). Алгоритм вычислений был реализован в программе для ЭВМ на языке Python (Демидовский А.А.). Дополнительно для последовательностей RR-интервалов вычисляли среднюю частоту сердечных сокращений (ЧСС, уд/мин) и стандартное отклонение (SDNN, мс).
Для статистического анализа полученных данных использовали программу STATISTICA 10. Для проверки нормальности распределения переменных использовали критерий Шапиро-Уилка. Для сравнения переменных в условиях до и во время стресса использовали критерий Стьюдента для связанных выборок (для переменных, имеющих нормальное распределение: ЧСС) и критерий Уилкоксона (для переменных, распределения которых отличались от нормального: ApEn, SDNN). Для оценки динамики переменных от момента приема алкогольного или безалкогольного напитков использовали дисперсионный анализ с повторными измерениями (ANOVA) (для переменных, имеющих нормальное распределение: ApEn, ЧСС) и критерий Фридмана (для переменных, распределения которых отличались от нормального: SDNN). Для сравнения контрольной и экспериментальной групп использовали критерий Стьюдента для независимых выборок (для переменных, имеющих нормальное распределение: ApEn, ЧСС) и критерий Манна-Уитни (для переменных, распределения которых отличались от нормального: SDNN). Во всех статистических оценках достоверными считали различия при уровне p < 0,05.
Результаты исследования
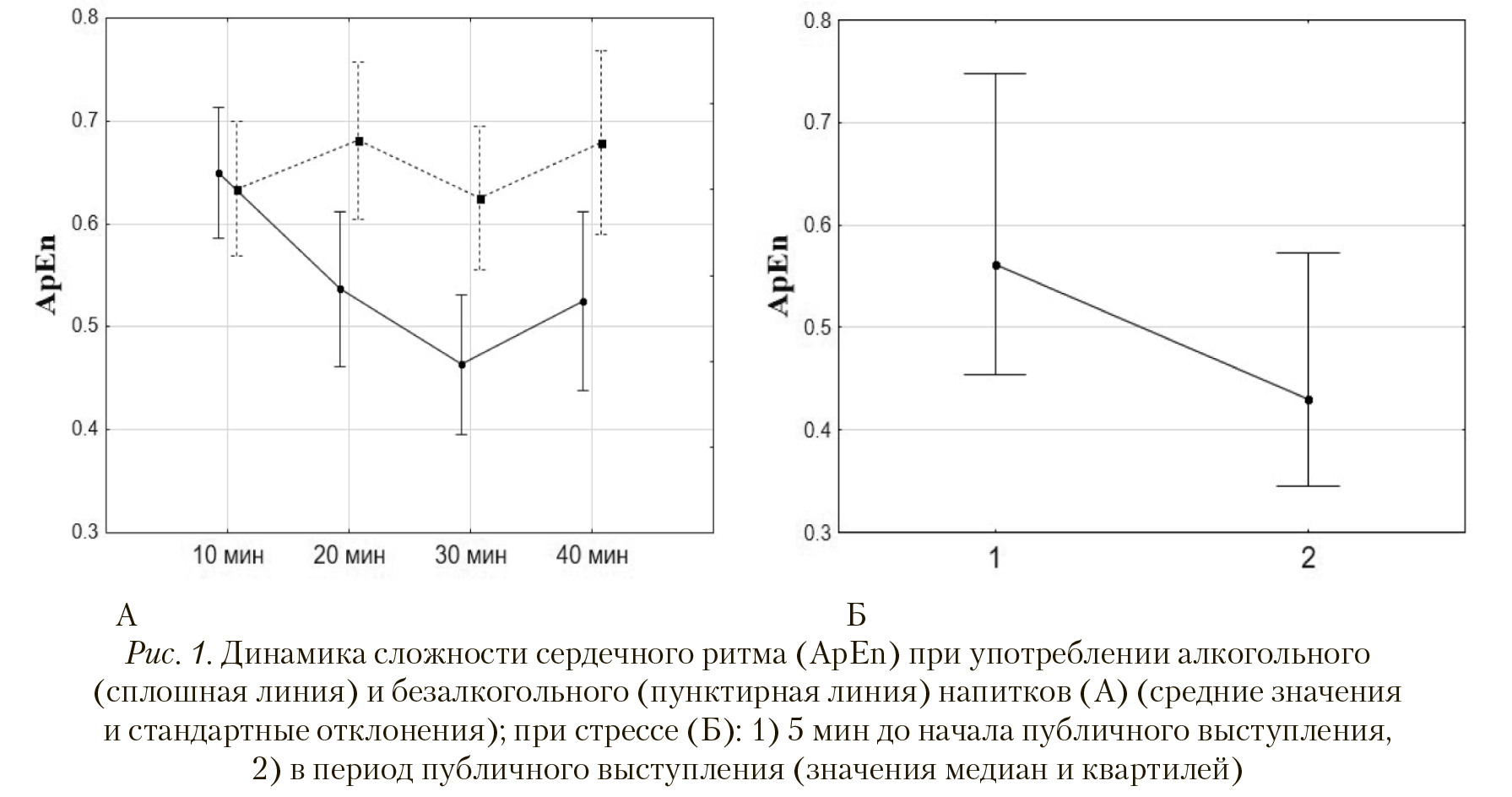
Сравнение характеристик ВСР до и во время стресса показало достоверное снижение ApEn (p < 0,05, критерий Уилкоксона) (рис. 1Б), стандартного отклонения RR-интервалов (р < 0,01, критерий Уилкоксона) и возрастание ЧСС (р < 0,05, критерий Стьюдента для связанных выборок) (табл. 1).
Таблица 1
Описательные статистики характеристик вариабельности сердечного ритма до и во время стресса
|
Показатель ВСР |
До стресса |
Во время стресса |
||||||
|
M |
Med |
SD |
25% 75% |
M |
Med |
SD |
25% 75% |
|
|
ApEn |
0,58 |
0,56 |
0,18 |
0,45 0,75 |
0,48 |
0,43 |
0,19 |
0,35 0,57 |
|
SDNN (мс) |
49,50 |
43,17 |
25,11 |
34,17 62,50 |
32,30 |
26,91 |
21,87 |
14,25 49,01 |
|
ЧСС (уд/мин) |
102 |
101 |
17,5 |
88 118 |
129 |
128 |
21,8 |
113 146 |
Примечание: «*»– p ≤ 0,05, критерий Стьюдента для ЧСС и критерий Уилкоксона для ApEn и SDNN.
В экспериментальной группе при сравнении характеристик ВСР за периоды времени от начала приема спиртного напитка (10, 20, 30, 40 мин) была выявлена динамика снижения ApEn сердечного ритма от начала к 30 минуте (табл. 2, рис. 1А) (F[Александров, 2016] = 13,17, p < 0,01, ANOVA). От 30 мин к 40 мин наблюдалось увеличение энтропии (р < 0,05, критерий Стьюдента), но не достигающее изначального уровня - ApEn в начале эксперимента (10 мин) была выше, чем в конце (40 мин) (p < 0,01, критерий Стьюдента). В динамике SDNN отсутствовали достоверные изменения (х2=3,57, p>0,05, критерий Фридмана). Динамика ЧСС характеризовалась возрастанием в середине периода эксперимента - к 30 мин (F[Александров, 2016]=4,29, p < 0,01, ANOVA).
В контрольной группе при сравнении характеристик ВСР за периоды времени от начала приема напитка (10, 20, 30, 40 мин) было выявлено отсутствие достоверных изменений в динамике ApEn (F[Александров, 2016] = 1,62, p > 0,05, ANOVA) (табл. 2, рис. 1А). В динамике SDNN отсутствовали достоверные изменения (F[Александров, 2016] = 1,76, p > 0,05, ANOVA). В динамике ЧСС выявлено снижение после 10 мин от употребления напитка (F[Александров, 2016]=7,54, p < 0,01, ANOVA) (табл. 2).
Значения ApEn были достоверно выше в контрольной группе по сравнению с экспериментальной на 20, 30 и 40 минутах эксперимента (критерий Стьюдента) (табл. 2, рис. 1А). В эти же периоды значения ЧСС были достоверно ниже в контрольной группе в сравнении с экспериментальной. Значения SDNN не отличались в контрольной и экспериментальной группах (критерий Манна-Уитни) (табл. 2).
Подробнее результаты анализа приведены в таблице 2.
Обсуждение результатов
В данной работе продемонстрировано снижение сложности сердечного ритма при стрессе и алкоголизации, что, согласно исходному предположению, рассматривается нами как проявление временной системной дедифференциации.
Результаты проведенного нами анализа динамики ВСР при стрессе согласуются с имеющимися в литературе примерами снижения сложности сердечного ритма при экзаменационном стрессе (Melillo et al., 2011) и геморрагическом шоке (Batchinsky et al., 2007). Примечательно, что если рассматривать шок как крайнюю степень выраженности стресса
Таблица 2
Динамика характеристик вариабельности сердечного ритма от начала
приема алкогольного и безалкогольного напитков
|
Время от начала приема напитка |
10 мин |
20 мин |
30 мин |
40 мин |
||||||||
|
Медианы, квартили |
M |
SD |
25% 75% |
M |
SD |
25% 75% |
M |
SD |
25% 75% |
M |
SD |
25% 75% |
|
Med |
Med |
Med |
Med |
|||||||||
|
Алкоголь АрЕп |
0,65 0,65 *&# |
0,14 |
0,52 0,78 |
0,54 0,54 & |
0,15 |
0,44 0,66 |
0,46 0,48 # |
0,13 |
0,38 0,57 |
0,52 0,55 |
0,17 |
0,39 0,65 |
|
Контроль АрЕп |
0,63 0,64 |
0,13 |
0,56 0,73 |
0,68 0,72 + |
0,17 |
0,59 0,82 |
0,63 0,64 + |
0,16 |
0,49 0,71 |
0,67 0,74 + |
0,21 |
0,58 0,82 |
|
Алкоголь БЭКК (мс) |
59,96 54,96 |
24,30 |
44,40 67,69 |
67,50 55,42 |
31,56 |
44,58 80,43 |
69,99 60,27 |
41,79 |
42,39 69,12 |
65,09 57,39 |
32,16 |
41,97 74,17 |
|
Контроль БЭКК (мс) |
73,25 66,34 & |
28,78 |
48,10 99,84 |
78,44 73,57 |
29,58 |
60,52 87,16 |
86,43 78,33 |
37,11 |
66,67 105,13 |
82,70 71,23 |
44,25 |
51,41 131,97 |
|
Алкоголь ЧСС (уд/ мин) |
83 83 & |
11,08 |
77 88 |
83 83 & |
10,25 |
80 89 |
85,95 86,73 |
11,20 |
82 94 |
86 88 |
14,02 |
81 94 |
|
Контроль ЧСС (уд/ мин) |
79 78 *&# |
11,21 |
67 86 |
75 75 + |
10,69 |
69 81 |
75,54 72,62 + |
10,47 |
69 83 |
75 73 + |
11,10 |
69 81 |
Примечание: «+» - р < 0,05 при сравнении контрольной и экспериментальной групп, критерий Манна-Уитни для БЭКК, критерий Стьюдента для АрЕп и ЧСС; «*» - р < 0,05 при сравнении с этапом 20 мин, «&» - р < 0,05 при сравнении с этапом 30 мин, «#» - р < 0,05 при сравнении с этапом 40 мин, критерий Уилкоксона для БЭКК в контрольной группе и критерий Стьюдента для АрЕп, ЧСС и БЭКК в экспериментальной группе.
Нами не были найдены результаты исследований последствий введения алкоголя, в которых было бы продемонстрировано снижение сложности сердечного ритма (по энтропийным или иным нелинейным параметрам), однако встречаются исследования, результаты которых демонстрируют снижение стандартного отклонения ВСР и спектральной плотности мощности в диапазоне высоких частот (Asharya et al., 2006).
Полученные нами в этой работе данные относительно снижения сложности сердечного ритма от начала приема спиртного напитка к 30 минуте совпадают с описанной в литературе динамикой резорбции этанола в течение кинетической фазы, продолжительность которой колеблется (в зависимости от дозы, индивидуальных метаболических характеристик и опыта употребления алкоголя) от 20 до 60 мин (Баринская и др., 2007). Данный период, когда концентрация алкоголя в крови и других биосредах увеличивается, после чего наступает ее снижение, известен как фаза элиминации. Можно предполагать, что при более длительной регистрации сердечного ритма (до трех часов) будет наблюдаться постепенное возрастание его сложности, но более медленное, чем первоначальное снижение, так как фаза элиминации в кинетике этанола значительно более длительная, чем фаза резорбции. Интересным является тот факт, что подобное наблюдаемому в наших данных снижение сложности сердечного ритма показано и для острого введения кокаина (вероятно, еще одного «дедифференциатора»), причем ApEn снижается в этом случае тем больше, чем выше вводимая доза (Newlin et al., 2000). Таким образом, снижение сложности сердечного ритма не только качественно отражает наличие системной дедифференциации, но и, по всей видимости, количественно связано с ее степенью.
На основании вышеописанных результатов можно сформулировать гипотезу о положительной связи степени дифференцированности систем, обеспечивающих поведение, и сложности сердечного ритма, регистрируемого в этом поведении (рис. 2). Эта связь объясняется тем, что с увеличением количества систем1, актуализированных в поведении, и соответствующим ростом количества межсистемных связей растет количество элементов, с которыми согласуется активность сердца для достижения общеорганизменного результата. Ранее было показано, что при переходе от одного поведенческого акта к другому (т. е. при изменении цели поведения) изменяется как состав вовлекающихся в поведение центральных нейронов, так и свойства их активности, в то время как изменения периферических нейронов в процессе данного перехода касаются в большей степени не состава участвующих клеток (они вовлекаются в разное поведение), а характеристик их активности; таким образом, одни и те же периферические нейроны в разных актах могут согласовывать свою активность с разными составами центральных нейронов (Александров, 1989). Мы полагаем, что характеристики активности сердца (и других внутренних органов) сходны с характеристиками активности периферических нейронов: сердце вовлекается в самые разные формы поведения, согласуя свою активность с разными наборами центральных нейронов. С данным положением согласуются результаты многих исследований, демонстрирующих положительные корреляции между активностью коры головного мозга (фМРТ, ПЭТ) и характеристиками ВСР. Например, показаны положительные корреляции между мощностью высокочастотных колебаний сердечного ритма и активностью: в области хвостатого ядра, инсулы, медиальной префронтальной коры при просмотре эмоциональных видеокадров (Lane et al., 2009), в области передней поясной извилины в задаче Струпа (Matthews et al., 2004), в области гипоталамуса, мозжечка, миндалины, гиппокампа, таламуса, дорсомеди- альной и дорсолатеральной коры, задней островковой коры, средней височной коры и др. при выполнении моторной задачи (grip task) (Napadow et al., 2008). Это положение также объясняет многие эффекты интероцептивной включенности в эмоциональные, когнитивные, и, в целом, поведенческие процессы (Crithley, Harrison, 2013).
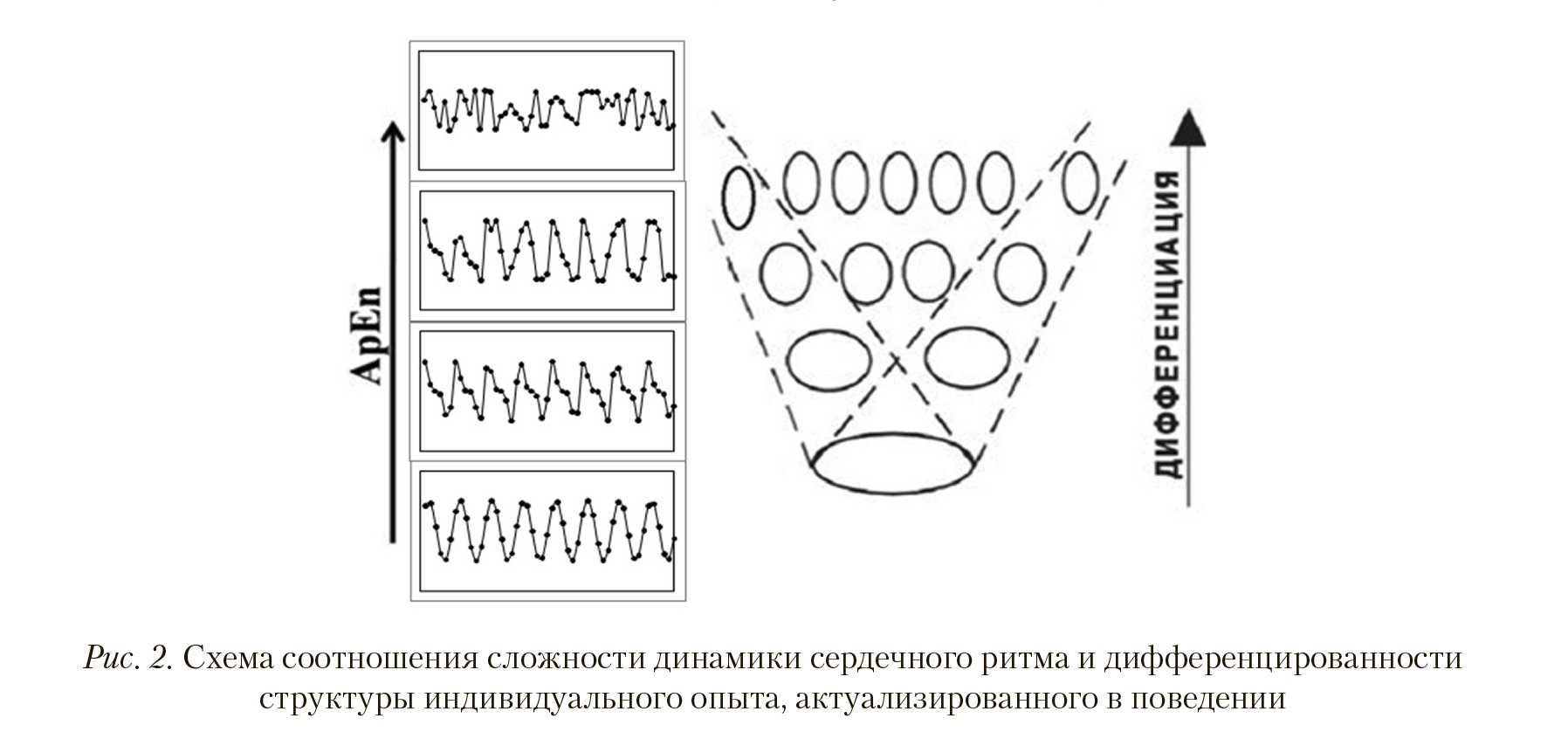
Дополнительными аргументами в пользу нашей гипотезы являются данные литературы о связи сложности динамики сердечного ритма и эмоциональности поведения. Стоит отметить, что ситуации повышенной эмоциональности также характеризуются временным снижением дифференцированности актуализированного в поведении набора функциональных систем (Александров, 2006). В своем исследовании Г. Валенца с соавторами (Valenza et al., 2012) использовали изображения из базы IAPS для сопоставления параметров эмоций и показателей ВСР; результаты данного исследования указывают на то, что ApEn выше при просмотре нейтральных картинок, чем картинок с ненулевым уровнем эмоционального возбуждения (arousal), независимо от их валентности. Обратная динамика была продемонстрирована в исследовании И. Гроссман с соавторами: ими была получена положительная корреляция между ВСР и количеством рационально взвешенных (wiser reasoning) решений, выносимых испытуемыми в задаче выявления политико-социальных проблем (Grossman et al., 2016).
На основе сформулированной гипотезы можно ожидать, что сложность сердечного ритма будет увеличиваться с возрастом, так как в процессе индивидуального развития взаимодействие организма со средой становится все более дифференцированным за счет приобретения новых элементов индивидуального опыта. Однако здесь стоит принимать во внимание возрастные морфологические изменения, а именно увеличение вероятности наличия и выраженности сердечно-сосудистых нарушений, которые, как правило, сопровождаются снижением ВСР. Хотя в исследованиях возрастной динамики ВСР всегда отслеживается фактор наличия сердечно-сосудистых заболеваний, все же в демонстрируемых эффектах наблюдаются некоторые противоречия, в основном объяснимые, на наш взгляд, разными контекстами экспериментов. Так, например, в результате проведенного сравнительного анализа показателей ВСР у детей (до 15 лет) и у молодых людей (от 15 до 40 лет) выявлено, что наблюдаемое с возрастом увеличение ВСР проявляется только в стандартном отклонении сердечного ритма и спектральных показателях, в то время как различий в сложности сердечного ритма между этими возрастными группами обнаружено не было (Pikkujamsa et al., 1999). Далее, сравнительный анализ групп молодых людей (от 15 до 40 лет), людей среднего возраста (от 40 до 60 лет) и людей старшего возраста (старше 60 лет) указывает на снижение вариабельности сердечного ритма и его сложности. Однако в другом исследовании при сравнении детей (от 5 до 15 лет) и молодых людей (от 15 до 30 лет) показан обратный эффект - увеличение сложности сердечного ритма, при этом стандартное отклонение уменьшается, а далее оба показателя имеют тенденцию к снижению по мере увеличения возраста (до 70 лет) (Acharya et al., 2004). Такие отличия, по всей видимости, связаны с тем, что в первом случае запись сердечного ритма проводилась в течение 24 часов с использованием Холтеровского мониторирования, для анализа использовались длинные последовательности (от 1 до 2 часов), при этом никак не контролировалась двигательная и поведенческая активность. Во втором случае запись проводили в состоянии покоя (сидя, с закрытыми глазами) 5 минут. Отсутствие разности в сложности сердечного ритма между детьми и молодыми людьми в первом случае может объясняться тем, что дети за период 1-2 часа чаще изменяют свою поведенческую активность, а вместе с тем растет и нерегулярность, и соответственно сложность, динамики сердечного ритма. Иными словами, возрастная динамика сложности сердечного ритма имеет колоколобразную форму с максимумом в период от 20 до 40 лет. Подобная колоколобразная (U-shaped) форма наблюдается и в случае динамики некоторых поведенческих характеристик, как, например, флуктуации центра тяжести при выполнении моторной задачи (Vaillancourt, Newell, 2002). Снижение же сложности сердечного ритма с возрастом после 20-40 лет может, с нашей точки зрения, объясняться особыми изменениями в системной организации поведения. Так, данные психологических исследований демонстрируют, что с возрастом у взрослых снижается утилитарность моральных суждений, растет эмоциональная значимость межличностных отношений и значимость эмоциональных аспектов жизни (Arutyunova et al., 2016). Можно предположить, что нарастающая с возрастом интеграция постоянно дифференцирующегося опыта (называемая в соответствующей литературе «дедифференциацией» (Li, Lindenberger, 1999)) обусловливает уменьшение различий наборов систем, актуализируемых в поведении при переходе от акта к акту, от состояния к состоянию. Это и может проявляться в старости как стойкое уменьшение сложности (в том числе и уменьшение разнообразия динамики сердечного ритма), характерное для временной «дедифференциации».
Заключение
Временная системная дедифференциация, вызванная ситуацией стресса или употреблением алкоголя, качественно и количественно отражается в снижении сложности (аппроксимированной энтропии) динамики сердечного ритма. Это является результатом уменьшения количества актуализированных систем и межсистемных связей, с которыми сердце согласует свою активность, встраиваясь в общий процесс разворачивания поведения.
Ограничения
Ограничение приведенного исследования заключается в организации самой процедуры исследования; поскольку возникают существенные различия в протоколах экспериментов по изучению динамики сложности сердечного ритма при стрессе и алкоголе, то результаты двух экспериментальных серий нельзя сравнить между собой. Можно предположить, что динамика сложности сердечного ритма характеризуется наличием особых специфических черт, которые отличают дедифференциацию в двух состояниях - при стрессе и при употреблении алкоголя.
Финансирование
Работа выполнена при поддержке гранта РФФИ (проект № 16-36-60044 мол_а_дк «Соотношения характеристик вариабельности сердечного ритма и степени дифференцированности системной организации реализуемого поведения») в рамках исследовательской программы Ведущей научной школы РФ «Системная психофизиология» (НШ-9808.2016.6).
Благодарности
Авторы благодарят за помощь в проведении экспериментов М.Е. Чугрову.
1 В ходе индивидуального развития возникают все более дифференцированные поведенческие акты(с точки зрения достигаемых во взаимодействии со средой результатов), которые присоединяются к раннее сформированным. Поэтому возрастание степени дифференцированности функциональных систем непосредственно связано с ростом их количества