Осциллирующая активность нейронов обнаружена в разных отделах ЦНС, а спонтанная периодическая активность является характерной чертой развивающейся нейронной системы (Alle’ne et al., 2008; Furlan et al., 2008). Задолго до того, как органы чувств и движения начнут выполнять свои функции, спонтанная нейронная активность детектируется во многих отделах мозга: например, ганглиозные клетки сетчатки зародыша крысы спонтанно активны в то время, когда сетчатка еще слишком незрелая для того, чтобы передавать зрительную информацию. Во время пренатального периода фоторецепторов слишком мало, а биполярные клетки отсутствуют, биполярные клетки соединяются с фоторецепторами и ганглиозными клетками после рождения. Спонтанная активность развивающихся нейронов, хотя и не несет сенсорной информации, чрезвычайно важна для формирования связей нервной системы. Эксперименты показывают, что нарушение спонтанной электрической активности ганглиозных клеток (например, блокатором натриевых каналов тетродотоксином или электрическими воздействиями соответствующих параметров) изменяет настройку топографической проекции сетчатки и разведение синаптических входов от двух глаз. Эти явления обнаружены как при развитии зрительной системы, так и при ее регенерации у взрослых животных (Sretavan et al., 1988). Большая часть ретинальных ганглиозных клеток во время пренатального развития демонстрирует ритмические паттерны разрядов, причем каждая клетка имеет свой ритм. Когда же две рядом расположенные клетки коррелируют по разрядам, то они имеют общий ритм, рядом расположенные клетки синхронно генерируют электрическую активность и молчат (Maffei, Galli-Resta, 1990).
В сетчатке ритмические разряды в виде спонтанных распространяющихся волн впервые появляются в пренатальном периоде и являются решающими для развития нейронных цепей внутри сетчатки и ЛКТ (Petit-Jacques, Bloomfield, 2008). Ранняя спонтанная активность провоцирует рост дендритов у ганглиозных клеток сетчатки (Mehta, Sernagor, 2006). В развивающейся сетчатке ганглиозные клетки разряжаются залпами потенциалов действия, которые требуют значительного увеличения концентрации внутриклеточного кальция с периодичностью в минуты. Эта периодическая активность распространяется во внутренних слоях сетчатки в виде волн, побуждающих рядом расположенные ганглиозные клетки разряжаться синхронно. Ретинальные волны оказываются критичными для формирования проекции сетчатки в первичные области центральной зрительной системы и влияют на развитие самой сетчатки (Firth et al., 2005). Приведены данные о роли спонтанной активности на ранних этапах формирования зрительной системы, хотя аналогичные факты существуют относительно организации движений, циркадианных ритмов и активирующей системы мозга.
Как же возникает спонтанная активность, которая оказывается столь существенной для создания нейронных ансамблей в созревающей нервной системе? Часть клеток имеет эндогенную по происхождению ритмику, которая в развитом организме выполняет множество различных функций. Можно предположить, что появление таких нейронов-генераторов происходит на ранних этапах дробления зиготы. Чтобы изучить этот процесс, необходимо обратиться к самому началу новой жизни – первым этапам в формировании нервной системы. Экспериментальные исследования, выполненные эмбриологами, показывают, что начало развития жизни связано с генерацией эндогенной осцилляторной активности. Эти осцилляции, постепенно распространяясь, охватывают всю яйцеклетку, а затем начинается дробление зиготы (Dumollard et al., 2002). Каковы же электрофизиологические характеристики зарождающихся клеток? На эмбрионах травяной лягушки были выполнены микроэлектродные регистрации электрической внутриклеточной активности отдельных бластомеров на разных этапах эмбриогенеза. Зарегистрирована активность 64 единиц. Результаты показали следующее: на ранних стадиях клеточной дифференциации (бластулы и гаструлы) почти любая клетка имеет потенциал покоя от –20 мВ до –42 мВ. У 70% клеток зарегистрирована осцилляторная электрическая активность. Амплитуда колебаний составляла 5–15 мВ. Осцилляции организованы в веретена, содержащие до 40 колебаний возрастающей амплитуды. Продолжительность во времени такого веретена не является постоянной – у одной и той же бластулы вариации составляют от 200 мс до 15 сек. Частота колебаний от 3–5 кол/с до 30 кол/с. По мере развития эмбриона и перехода в стадию органогенеза количество клеток, имевших осциллирующую активность, снижалось.
На самой ранней стадии дробления бластомеры начинают образовывать кластеры, объединяющие прообразы нейронов, наделенных определенными свойствами (Muller, 2001). Применение колхицина тормозит или даже полностью блокирует этот процесс (Bozhkova et al.,1983). По-видимому, такая реорганизация поверхности, формирование кластеров является первым проявлением системообразующей функции электрически активных бластомеров. Уровень мембранного потенциала, ионные токи и мембранная проводимость зависят от стадии деления клетки (Гойда и др., 1992). Осцилляторная активность бластомеров генетически задана – торможение трансляции информации циклогексимидом приводит к острой деполяриза ции мембраны и полному уничтожению мембранных осцилляций, которые в норме соответствуют митотическим циклам во время синхронной дифференциации бластомеров (Кузень и др., 1980). Осцилляции мембранного потенциала зависят от аденилатциклазной системы.
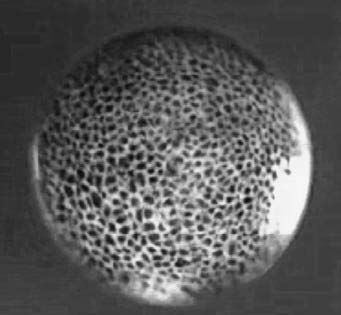
Рис. 1. Зигота травяной лягушки в стадии бластулы (изображение увеличено в 45 раз)
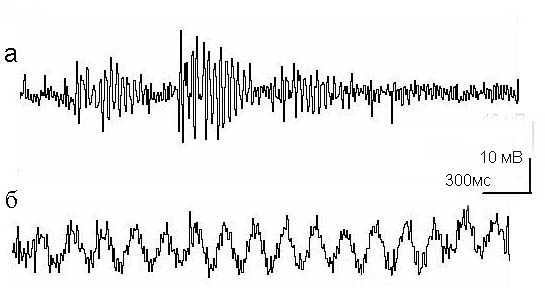
Рис. 2. Электрическая активность бластомера
а – веретенообразная активность частотой 35 Гц. Уровень мембранного потенциала бластомера – 35 мВ; б – низкочастотная синусоидальная активность частотой 5 Гц, зарегистрированная у того же самого бластомера. Длительность генерации этих колебаний – 15 с. Калибровка: 300 мс, 10 мВ
Присутствие ритмической активности на самых ранних этапах развития у многих клеток приводит к предположению о том, что, во-первых, генетически заданная, инициирующаяся на самых ранних этапах развития активность может быть ориентиром для формирующейся нервной системы (клетки с этой ритмикой являются своеобразными «маркерами», размечающими путь связи между зарождающимися элементами будущей ЦНС); во-вторых, они становятся системообразующей основой для формирования различных функциональных ансамблей нейронов, и играют роль центров, вокруг которых создается своеобразное синаптическое «кружево» – множество клеток с синаптическими переключениями, обладающих определенными свойствами и задействованные в различных жизненных задачах организма (O’Donovan,1999). Так как клетки – носители генетически заданной пейсмекерной программы – становятся структуро-образующими элементами, формирующими вокруг себя систему синаптически связанных клеток, то от их собственных врожденных свойств зависят многие особенности создаваемых нейронных систем, а следовательно, и поведенческих особенностей организма.
Так, экспериментальные данные показывают, что в основе инициации спонтанной активности, которая регистрируется у многих нейронов развивающейся ЦНС, лежат эндонейрональные по происхождению осцилляции, по крайней мере, некоторых нервных клеток. Cпонтанная нейронная активность зависит от свойств, которыми наделены эти клетки, так как нейроны-генераторы определяют и характеристики нейронных ансамблей. Особенно важным свойством является высокая возбудимость рекуррентно соединенных развивающихся сетей и легко возникающее после повышенной активности снижение возбудимости. Предполагается, что в спинном мозге взаимодействие именно этих свойств отвечает за спонтанную активность нейронов (O’Donovan, 1999).