Введение
Структурой головного мозга человека, исследования которой в последнее время вызывают пристальный интерес специалистов в области когнитивных и нейрокогнитивных исследований, является цингулярная кора (кора поясной извилины), расположенная на медиальной поверхности головного мозга, между мозолистым телом и поясной бороздой. Данная область мозга, являясь составной частью лимбической системы, получает афферентные сигналы от передней группы ядер таламуса, а эфферентные сигналы из цингулярной коры идут в парагиппокампальную извилину и далее в гиппокамп. Кроме того, цингулярная кора имеет многочисленные двусторонние связи с лобной, теменной и затылочной корой больших полушарий.
В цитоархитектоническом отношении цингулярная кора довольно неоднородна. По классификации К. Бродмана, в ней различают семь полей – 23, 24, 26, 29, 30, 31 и 33. Однако в связи с тем, что точные границы между некоторыми полями практически невозможно точно визуально различить на томограммах, в последнее время в цингулярной коре выделяют только три крупных отдела: переднюю (поля 24 и 33), заднюю (поля 23 и 31) и ретросплениальную (поля 26, 29 и 30) кору. Иногда в задней цингулярной коре дополнительно выделяют вентральную (поле 23) и дорсальную (поле 31) части (рис. 1).
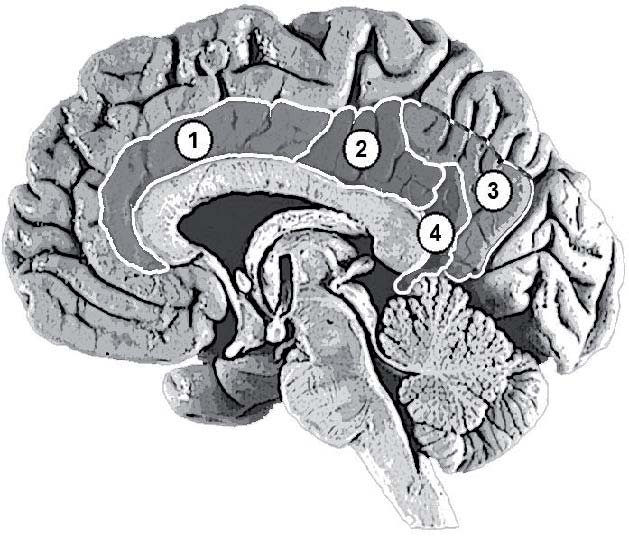
Рис. 1. Отделы цингулярной коры: 1 – передняя (поля 24 и 33); 2 – задняя вентральная (поле 23); 3 – задняя дорсальная (поле 31); 4 – ретросплениальная (поля 26, 29 и 30) кора
Необходимо отметить, что функциональная роль цингулярной коры в настоящее время остается спорной, несмотря на большое количество публикаций и множество выдвигаемых в них гипотез.
Наиболее подробно исследован передний отдел цингулярной коры. Так, в многочисленных работах показано, что активность передней цингулярной коры наблюдается при выполнении заданий, требующих произвольного контроля деятельности, включая детекцию ошибок, мониторинг конфликта и/или переключение внимания, а также в тестах на исполнительный компонент рабочей памяти. Клинические данные о поражении этой области мозга у людей и экспериментальные данные на животных также свидетельствуют о том, что при поражении задней цингулярной коры наблюдаются трудности при выполнении заданий, требующих когнитивного контроля (Rushworth et al., 2003; Botvinick et al., 2004; Kerns et al., 2004; Lenartowicz, McIntosh, 2005; Otsuka et al., 2006; Carter, van Veen, 2007; Posner et al., 2007; Hyafil et al., 2009). Исследования с использованием метода морфометрического анализа свидетельствуют, что у больных шизофренией часто наблюдается снижение объема передней цингулярной коры (Choi et al., 2005; Mitelman et al., 2005; Koo et al., 2008).
Задняя цингулярная кора исследована значительно хуже: согласно базе данных PubMed, упоминания об этой части коры головного мозга встречаются в публикациях почти в шесть раз реже, чем упоминания о передней цингулярной коре. Так, известно, что у здоровых людей при извлечении воспоминаний из автобиографической эпизодической памяти наблюдается сильная активация в области задней цингулярной коры (Maddock et al., 2001). Причем при извлечении информации из эпизодической, но не автобиографической памяти активации в этой области мозга не наблюдается (Ries et al., 2006). Кроме того, показано, что активация задней цингулярной коры также наблюдается при узнавании знакомых слов, предметов или мест (Sugiura et al., 2005; Heun et al., 2006). В задней цингулярной коре макак обнаружены так называемые «нейроны риска», которые активируются при выборе обезьяной рискованного варианта, причем степень активации коррелирует со степенью риска (McCoy, Platt, 2005). Электростимуляция таких нейронов в момент связанного с риском выбора приводила к тому, что в следующей пробе подопытные макаки выбирали менее рискованный вариант (Hayden et al., 2008).
Что касается функциональной роли ретросплениальной цингулярной коры, то работы, где исследовалась роль этой области мозга, особенно редки. Известно, что при поражении данной области наблюдается сильная антероградная амнезия (Oka et al., 2003; Kim et al., 2007). Кроме того, существуют данные, свидетельствующие о задействованности данной области мозга в возникновении эмоциональных процессов: так, к примеру, при восприятии испытуемыми эмоционально окрашенных слов наблюдается активация в данной области мозга (Cato et al., 2004). Имеются данные об активации данной области коры головного мозга в процессе пространственной навигации. При запоминании незнакомых маршрутов в трехмерном пространстве наблюдается активация гиппокампа и/или парагиппокампальной извилины, в то время как при ориентировке в уже знакомых местах наблюдается активация в районе ретросплениальной коры (Epstein et al., 2007; Iaria et al., 2007; Epstein, 2008). Так, приводится описание случая пациента с кровоизлиянием в область левой ретросплениальной области, который потерял способность ориентироваться в пространстве, но при этом тесты на пространственное мышление он выполнял достаточно успешно (Ino et al., 2007).
В последнее время для изучения роли различных структур мозга в когнитивных процессах активно применяется метод магнитно-резонансной морфометрии (МРММ). Например, получены многочисленные данные о связи объема гиппокампа, а также его различных областей с мнестическими процессами (Hackert et al., 2002; Maguire et al., 2006; Sozinova et el., 2008; Вартанов и др., 2009). Однако при изучении когнитивных функций цингулярной коры морфометрический анализ используется, к сожалению, лишь в клинических исследованиях. В данной работе предпринята первая попытка проследить при помощи метода МРММ роль основных отделов цингулярной коры правого и левого полушарий в осуществлении процессов памяти у здоровых людей пожилого возраста.
Методика исследования
Испытуемые. В исследовании приняли участие 29 женщин в возрасте от 60 до 76 лет (средний возраст – 67,7 лет; стандартное отклонение – 5,1), не имевших в прошлом какихлибо травм мозга, инсультов, психических или неврологических заболеваний; все они были правшами.
Процедура. Исследование включало два этапа. На первом этапе проводилось томографическое, а на втором – нейропсихологическое исследование испытуемых.
На этапе томографического исследования с помощью магнитно-резонансного томографа Phillips Achieva 3.0T X создавались трехмерные изображения мозга в режиме T1. Затем на специально стандартизированных, приведенных к изотропному шагу по всем направлениям сагиттальных срезах томограмм нами выделялись части изображения, относящиеся к цингулярной коре левого и правого полушарий. В каждом полушарии выделялись четыре визуально различимые области цингулярной коры – передняя (поля 24 и 33 по Бродману), задняя вентральная (поле 23 по Бродману), задняя дорсальная (поле 31 по Бродману) и ретросплениальная (поля 26, 29 и 30 по Бродману). Далее с помощью специально разработанного программного обеспечения подсчитывалось количество пикселей, относящихся к каждому выделенному участку цингулярной коры, вычислялись абсолютные (в мм2) показатели площади поверхности этих областей мозга.
На этапе нейропсихологического исследования нами проводилось комплексное тестирование когнитивных процессов по методике А. Р. Лурия в модификации Ж. М. Глозман (1999), позволяющей количественно оценивать показатели памяти. Использовались следующие тестовые методики: I. Заучивание списка из 10 слов с отсроченным воспроизведением после гетерогенной интерференции (серийного счета). II. Запоминание двух групп слов и двух групп фраз с отсроченным воспроизведением после: а) гетерогенной и б) гомогенной интерференции. В качестве гетерогенной интерференции использовались задачи на вычитание в уме и на воспроизведение упроченных речевых рядов (дней недели в прямом и обратном порядке). В качестве гомогенной интерференции использовалась задача запоминания двух фраз, после которой нужно было вновь воспроизвести заученный ранее список слов. III. Проба на семантическое кодирование: запоминание 12 слов путем составления из них произвольных предложений и воспроизведение этих слов после 10-минутной гетерогенной интерференции (в качестве интерференции использовались двигательные пробы). IV. Пробы на зрительную память: запоминание легко (предметы) и трудно вербализуемых (сложные геометрические фигуры) изображений при их непосредственном и отсроченном воспроизведении в условиях гомогенной интерференции. V. Проба на ассоциативную память: запоминание слов, объединенных в пары, с последующей задачей воспроизведения второго слова сразу после предъявления первого в условиях гетерогенной интерференции. VI. Проба на зрительно-пространственную память: копирование фигур в условиях гетерогенной интерференции с последующим непосредственным и отсроченным воспроизведением.
Для каждого вида памяти оценивались: 1 – объем памяти (количество воспроизведенных элементов); 2 – прочность памяти (количество воспроизведенных элементов после интерференции); 3 – ошибки памяти. Различалось несколько типов ошибок при воспроизведении запомненной информации: А – замены элементов (отдельно фиксировались семантические, фонетические/перцептивные ошибки); Б – конфабуляции (включение новых элементов); В – контаминации (смешение нескольких элементов); Г – персеверации (воспроизведение одного и того же элемента несколько раз); Д – ошибки порядка следования элементов.
В процессе обработки на основе полученных данных были рассчитаны непараметрические корреляции (коэффициент Спирмена) между индивидуальными поведенческими и анатомическими показателями. В дальнейшем анализировались только статистически значимые (p < 0,05) взаимосвязи.
Результаты
На данной относительно гомогенной в возрастном отношении выборке испытуемых нами не было обнаружено каких-либо корреляций между возрастом испытуемых и площадью цингулярной коры левого и правого полушарий, а также площадью отдельных полей данной области мозга. Напротив, подсчет коэффициентов корреляции между площадью цингулярной коры и результатами нейропсихологических тестов в ряде случаев выявил значимые взаимосвязи. Эти взаимосвязи, однако, были различными для разных областей. Суммарные показатели для левого и правого полушарий передней цингулярной коры (поле 24 по Бродману) приведены в табл. 1.
Таблица 1. Суммарные показатели корреляции между поведенческими показателями памяти и площадью передней цингулярной коры
|
|
Левое полушарие |
Правое полушарие |
Оба полушария |
|
Количество конфабуляций в пробе на семантическое кодирование |
-0,51 |
– |
– |
|
Количество конфабуляций при воспроизведении списка из 10 слов |
– |
– |
-0,32 |
|
Количество запомненных слов при запоминании списка из 10 слов |
– |
-0,32 |
-0,33 |
|
Количество запомненных элементов в пробе на зрительную память |
– |
-0,37 |
– |
Приведенные в табл. 1 данные демонстрируют взаимосвязь результативности выполнения тестов на память с площадью передней цингулярной коры. Так, размеры цингулярной коры в левом полушарии отрицательно коррелируют с числом конфабуляций в пробах на семантическое кодирование и воспроизведение слов, что может свидетельствовать об увеличении точности воспроизведения. Вместе с тем, для передних отделов цингулярной коры правого полушария наблюдается отрицательная корреляция с общим объемом воспроизведенного вербального и особенно невербального материала, т. е. чем больше площадь данной области мозга, тем меньше предъявленных ранее элементов воспроизводится испытуемыми. Результаты тестов на зрительную память обнаруживают тенденцию взаимосвязи с размерами правой передней цингулярной коры, а тесты на семантическое кодирование и запоминание чисел – с размерами левой.
Значимые корреляции были выявлены между результатами нейропсихологических тестов и площадью вентральной части задней цингулярной коры (поле 23). Как видно из данных, приведенных в табл. 2, с увеличением размеров этой области справа происходит уменьшение количества ошибок конфабуляционного типа в пробах на семантическую память. Одновременно, однако, у испытуемых с относительно обширной левой вентральной областью наблюдаются многочисленные ошибки, связанные с изменением порядка воспроизведения элементов и их персевераторного повторения. Ошибки такого рода наблюдаются как в вербальных, так и невербальных тестах.
Таблица 2. Суммарные показатели корреляции между поведенческими показателями памяти и площадью вентральной части задней цингулярной коры
|
|
Левое полушарие |
Правое полушарие |
Оба полушария |
|
Количество конфабуляций в пробе на семантическое кодирование |
– |
-0,40 |
– |
|
Количество воспроизведенных геометрических фигур в пробе на зрительную память |
-0,44 |
– |
– |
|
Ошибки порядка воспроизведения в пробе на запоминание двух слов и двух фраз |
0,32 |
– |
– |
|
Ошибки порядка воспроизведения элементов в пробе на зрительную память |
0,41 |
– |
– |
|
Ошибки порядка воспроизведения при запоминании чисел |
0,37 |
– |
0,41 |
|
Персеверации при воспроизведении в пробе на запоминание двух слов и двух фраз |
0,33 |
– |
– |
|
Персеверации при воспроизведении в пробе на зрительную память |
0,40 |
– |
– |
Не менее специфичной оказывается представленная в табл. 3 картина корреляций между результатами нейропсихологических тестов памяти и площадью дорсальной части задней цингулярной коры (поле 31). Общее число выявленных корреляций оказывается здесь большим, чем для других полей. Содержательно размеры площади этого поля в левом полушарии отрицательно связаны с показателями объема памяти по вербальным и невербальным тестам, а также с увеличением интерференции материала и ростом числа конфабуляций в пробе на запоминание групп слов и фраз. Размеры правой дорсальной области отрицательно связаны с ошибками в порядке воспроизведения элементов в пробе на зрительную память.
Таблица 3. Суммарные показатели корреляции между поведенческими показателями памяти и площадью дорсальной части задней цингулярной коры
|
|
Левое полушарие |
Правое полушарие |
Оба полушария |
|
Количество конфабуляций в пробе на запоминание двух групп слов и двух фраз |
0,44 |
– |
– |
|
Ошибки порядка воспроизведения в пробе на зрительную память |
– |
-0,46 |
-0,41 |
|
Количество воспроизведенных слов в пробе на запоминание списка из 10 слов (до интерференции) |
-0,49 |
– |
-0,39 |
|
Количество воспроизведенных слов в пробе на запоминание списка из 10 слов (после интерференции) |
-0,39 |
– |
– |
|
Количество воспроизведенных слов в пробе на запоминание двух групп слов и двух фраз |
-0,45 |
– |
– |
|
Количество воспроизведенных геометрических фигур в пробе на зрительную память |
-0,45 |
– |
-0,41 |
|
Количество воспроизведенных элементов в пробе на зрительную память (после интерференции) |
-0,41 |
|
-0,38 |
Наконец, нами были обнаружены отдельные значимые корреляции между результатами нейропсихологических проб и площадью ретросплениальной области цингулярной коры (поля 26, 29 и 30 по Бродману). Эти данные показаны отдельно для левого и правого полушарий в табл. 4.
Таблица 4. Суммарные показатели корреляции между поведенческими показателями памяти и площадью ретросплениальной области цингулярной коры
|
|
Левое полушарие |
Правое полушарие |
Оба полушария |
|
Контаминации стимулов в пробе на запоминание двух групп слов и двух фраз |
– |
-0,42 |
-0,43 |
|
Количество воспроизведенных элементов в пробе на зрительную память (до интерференции) |
– |
-0,39 |
-0,53 |
|
Количество воспроизведенных элементов в пробе на зрительную память (после интерференции) |
-0,38 |
|
-0,45 |
Какой-либо выраженной специализации левой и правой ретросплениальной области цингулярной коры не наблюдается. Увеличение этой области мозга коррелирует с уменьшением числа семантических ошибок памяти по типу контаминации, но одновременно значимо снижается также и количество извлеченных из памяти элементов в тестах на зрительную память. Такое снижение происходит независимо от интерференционных воздействий.
Обсуждение и выводы
Полученные в данном исследовании результаты прежде всего свидетельствуют о правомерности постановки вопроса относительно возможной количественной связи результативности выполнения нейропсихологических тестов на память с анатомическими особенностями цингулярной коры, выявляемыми с помощью метода МРТ. При увеличении некоторых из областей цингулярной коры наблюдается снижение количества ошибок в самых разных тестах на память. При этом, однако, снижение числа ошибок обычно не сопровождается улучшением результативности запоминания, – напротив, общая тенденция состоит в том, что количество воспроизведенных запомненных элементов также снижается.
Специфическая картина этих взаимосвязей может быть, в самом первом приближении, обобщена с помощью представлений о передне-заднем градиенте развития кортикальных функций, а также об известных различиях в функциях левого и правого полушарий (см.: Величковский, 2006; Кроткова, Величковский, 2008). В направлении от задних к эволюционно более новым передним областям коры увеличивается степень амодальности наблюдаемых эффектов и их связь с переработкой семантической информации, что выражается в нашем случае подавлением конфабуляций. Кроме того, левополушарные структуры чаще обнаруживают связь с результативностью вербальных тестов, чем правополушарные. Так, размеры передней цингулярной коры отрицательно коррелируют с числом конфабуляций в пробах на семантическое кодирование, что является важным признаком интактности префронтальных функций мозга (см., напр.: Turner et al., 2008). Несколько парадоксальный характер взаимоотношений результативности тестов на память с размерами большинства областей цингулярной коры мог бы быть объяснен в рамках традиционных представлений о выполняемой ею функции центрального произвольного регулятора когнитивной активности, тормозящего потенциально иррелевантную информацию.
Единая картина глобального градиентного изменения показателей функционирования памяти, с одной стороны, и локализации областей цингулярной коры – с другой, резко нарушается контрастными свойствами ее дорсальной части (поле 31). Эта область, во-первых, уникальна с точки зрения общего числа корреляций с тестами на память и, вовторых, является единственной областью, демонстрирующей положительную корреляцию с количеством конфабуляций.
Наше объяснение этого отличия, а также формулировка общего представления о роли обследованных областей цингулярной коры в функционировании памяти человека заключается в следующем предположении: роль передней цингулярной коры состоит в отвержении иррелевантной информации, в борьбе с интерференцией. Используя терминологию теории обнаружения сигналов, ее можно назвать системой фильтрации и подавления «шума». Данная гипотеза хорошо объясняет причину того, почему при хорошо развитой передней цингулярной коре снижение количества ошибок памяти в виде конфабуляций сопровождается общим снижением результативности извлечения из памяти: выбор консервативного критерия принятия решений обеспечивает хорошее подавление «шума» и сокращает число «ложных тревог», но одновременно снижает и число «правильных обнаружений». Роль же задней дорсальной цингулярной коры, по нашему мнению, противоположна – она занимается первоначальным выделением полезной информации, т. е. играет роль генератора потенциальных «сигналов» в системе выделения «сигнала» из «шума». Фактически мы выдвигаем гипотезу о существовании двух базовых подсистем цингулярной коры, реципрокно влияющих на выполнение нейропсихологических тестов на память, а возможно, и на другие когнитивные процессы.
Предложенное объяснение хорошо согласуется с данными других исследований. Так, если рассматривать переднюю цингулярную кору как систему подавления «шума», то становится понятным, почему в большинстве задач, где требуется отсеивать иррелевантную информацию, наблюдается активность данной области мозга. Если говорить о процессе извлечения из памяти, то в этом случае также требуется постоянный отсев некоторых мысленных представлений, побочных результатов работы воображения и планирования, которые, собственно, воспоминаниями не являются, тех воспоминаний, в которых человек до конца не уверен. Видимо, именно этим можно объяснить тот факт, что при извлечении самой разной информации – из пространственной (Teixeira et al., 2006), эпизодической (Herrmann et al., 2001), рабочей (Schoning et al., 2009), вербальной декларативной (Bremner et al., 2004) и эмоциональной (Tang et al., 2005) памяти – неизменно наблюдается активность передней цингулярной коры. Если исходить из предложенной гипотезы о функции цингулярной коры, то можно предположить, что, в случае, когда эта область мозга не функционирует в полную силу, при извлечении из памяти будут наблюдаться конфабуляции. Действительно, при атрофии передней цингулярной коры, например, при болезни Альцгеймера, наблюдаются сильные конфабуляции (Lee et al., 2009). Известно также, что при такой болезни, как шизофрения, которая сопровождается выраженными конфабуляторными нарушениями, часто наблюдается атрофия передней цингулярной коры (Choi et al., 2005; Mitelman et al., 2005; Koo et al., 2008). Если рассматривать заднюю дорсальную кору (поле 31) как область мозга, связанную с выделением «сигнала» из «шума», то становится возможным объяснение и ряда других описанных в литературе данных, в частности, получает объяснение феномен активации задней цингулярной коры при узнавании знакомых слов, предметов или мест (Sugiura et al., 2005; Heun et al., 2006).
Еще одним эмпирически установленным эффектом данного исследования является известное пересечение функциональных свойств близкорасположенных анатомических отделов. Полезным для объяснения этого результата является применение того же градиентного принципа. Например, задняя вентральная цингулярная кора (поле 23) находится на пересечении двух упомянутых выше реципрокных систем, обнаруживая в ослабленном виде свойства каждой из них. Так, усиленное анатомическое развитие этой области мозга сопровождается всплеском ошибок нарушения порядка воспроизведения и персеверации на фоне успешного преодоления семантических ошибок конфабуляции и контаминации. Другим важным градиентом изменения функциональных свойств этой и ряда других структур мозга, несомненно, является также дорсально-вентральный градиент. Применительно к передней цингулярной коре эти различия были, в частности, отмечены М. Познером и его коллегами как различия обработки информации в условиях когнитивных и, скорее, эмоционально-аффективных конфликтов (Познер, 2008; Posner et al., 2007).