Введение
Понятия «когнитивные резервы» или «компенсаторные резервы» мозга введены в терминологию как инструмент для объяснения широкого индивидуального разнообразия в изменениях когнитивных функций при старении. Они используются для изучения компенсаторных механизмов, позволяющих адаптироваться при развитии патологических процессов в мозге, и отражают структурные (размер мозга или количество синапсов) и функциональные (разнообразие и пластичность функциональных нейронных ансамблей) особенности мозга [Stern, 2009; Stern, 2013]. Эти характерные особенности формируются и продолжают развиваться или, напротив, «расходоваться» в онтогенезе в зависимости от воспитания, образования, стиля жизни и имеющихся задатков.
Такая пластичность нейронных систем мозга обеспечивает не только эффективное приспособление человека к постоянно изменяющейся жизненной среде, но и ее преобразование. Изучение механизмов нейропластичности и возможностей стимуляции когнитивных резервов актуально не только для понимания фундаментальных основ деятельности мозга, но и, с практической точки зрения, для совершенствования программ обучения и профессионального выбора или разработки путей и способов коррекции негативных эффектов старения мозга или нейрореабилитации пациентов, имеющих мозговые повреждения.
Достижения нейробиологии последних лет, особенно доказательства нейрогенеза во взрослом мозге и влияния на этот процесс эпигенетического фактора [Vasile, 2013], свидетельствуют о широких возможностях актуализации резервов мозга на основе стимуляции механизмов нейропластичности и формирования новых функциональных систем.
Анализ последствий сенсорной депривации, особенно депривации на ранних этапах развития мозга, можно рассматривать как модель реализации нейропластичности, обусловленной кросс-модальной перестройкой функциональных нейронных сетей для адаптации организма в соответствующей информационной среде.
Так, потеря зрения влечет за собой изменения в способностях к перемещению в пространстве, поиску объектов, чтению, распознаванию людей и общению с ними без доступа к таким невербальным признакам их состояния, как взгляд или выражение лица. Однако и слепые, и глухие, потерявшие возможность распознавания звуков и формирования речи, могут адаптироваться и эффективно функционировать в своей жизненной среде.
Какая же когнитивная реструктуризация необходима для создания пространственных представлений слепых с использованием только слуховой информации? Или как могут говорить и петь глухие? Какие преобразования происходят в функциональных системах мозга, когда их специализированные для обработки зрительной или слуховой информации структуры не получают этой стимуляции? Как в таких условиях происходит формирование внимания, памяти и других когнитивных функций?
Ответив на эти вопросы, мы поймем закономерности нейропластичности, формирования и реализации компенсаторных резервов мозга, что интересно не только теоретически, но и с позиций осознания возможностей развития новых подходов и новых методов реабилитации людей с поражением сенсорных систем или поражением мозга вследствие инсульта, опухоли или травмы.
Наряду с «классическим» подходом — образовательными программами для обучения слепых детей тому, как распознавать и эффективно использовать тактильные или звуковые сигналы для ориентации в пространстве, а глухих — для обучения пониманию и воспроизведению речи, все шире используются технические методы реабилитации, направленные не только на компенсацию, но и на восстановление утраченных сенсорных функций.
Разработка эффективных нейропротезов для восстановления зрительных или слуховых функций невозможна без понимания нейронных основ обработки и мультисенсорной интеграции информации разной модальности и роли индивидуальных особенностей и временной динамики механизмов нейропластичности.
Компенсаторные ресурсы мозга при сенсорной
депривации в зрительной системе
Обработка зрительной информации имеет большое значение в поведении человека, благодаря этому этого в организации зрительных функций принимает участие до 40% поверхности коры, охватывая не только окципитальные, но париетальные, темпоральные и фронтальные области [Mapping visual cortex, 2001]. Зрительная система организована топографически специализированными зонами, предназначенными для разных функций. Например, дорзальный зрительный пучок специализирован в обработке зрительно-пространственной и зрительно-моторной информации, тогда как вентральный путь — в опознавании объектов, в том числе фузиформная кора — в опознавании лиц. Такая диссоциация функций двух зрительных путей сохраняется и после потери зрения: дорзальный активируется при выполнении пространственных задач с опорой на слуховые и тактильные сигналы. При отсутствии зрительной информации зрительная кора может получать информацию от оставшихся интактными сенсорных систем и участвовать в организации когнитивных функций, например, памяти или речи. Однако эти функции обеспечивают новые нейронные системы, отличающиеся от тех, которые формируются при интактном зрении: например, снижением плотности межполушарных связей в первичной и ассоциативной зрительной коре [Hirsch, 2015], тогда как в височной коре связь контралатеральных областей, напротив, возрастает [A novel paradigm, 2018].
Следовательно, отсутствие информации одной из модальностей является триггером реорганизации сенсорной коры для компенсаторного обеспечения обработки той информации, которая поступает в мозг [Lazzouni, 2014].
Функциональная специализация мозга человека формируется на основе обработки информации, в первую очередь, в зрительно-слуховом пространстве с доминированием зрительной модальности на ранних этапах развития, что оказывает влияние на последующее формирование сенсорных систем [Shape perception and, 2017].
Вследствие этого при нарушениях нормального процесса совмещения обработки зрительной и слуховой информации следует ожидать изменений и в способностях к звуковой локализации. Действительно, при поражении зрительной системы нейронные ансамбли зрительной коры перестраиваются для повышения эффективности слуховой системы (в том числе — дискриминации звуков, слуховой чувствительности и обеспечения пространственной координации) [King, 2015].
Такие компенсаторные процессы приводят к расширению территории корковых областей, участвующих в обработке слуховых сигналов, и к соответствующему улучшению слуховых способностей [Lazzouni, 2014]. В результате не только слуховая, но и тактильная, и обонятельная системы приобретают более широкое представительство в мозге слепых людей [Shape perception and, 2017].
Участие зрительной коры мозга слепых людей в обработке незрительной информации доказано результатами многочисленных исследований. Последние данные свидетельствуют, что кросс-модальная реорганизация при зрительной депривации касается не только нейронных систем и их функциональной специализации, но и изменений в структуре зрительной коры, которые могут служить маркерами поведенческой адаптации [Voss, 2019].
Вследствие нейропластичности мозга его архитектура и функции изменяются на протяжении всей жизни.
Эти изменения происходят на разных уровнях: от отдельного нейрона и организации нейронных сетей до функций нервной системы в целом — и отражаются на поведенческом уровне, в том числе — показателями когнитивных функций. Потенциал нейропластичности отличается для разных структур мозга: высокая степень нейропластичности отмечена для гиппокампа, ассоциативных унимодальных и мультисенсорных областей коры [Bubic, 2010].
Наряду с такими регионарными особенностями нейропластичность зависима и от индивидуальных особенностей строения мозга, и от истории синаптической активности в процессе его развития не только в раннем детстве, но и во взрослом состоянии.
При этом возможны разные формы пластичности: формирование новых функциональных систем, как это происходит в детстве, или реорганизация ранее сформированных систем в зрелые годы жизни.
При поздней потере сенсорной чувствительности, патологическом поражении мозга или возрастной атрофии нервных клеток компенсаторный результат может быть опосредован разными путями с доминированием или маскировкой каждого из них в зависимости от перечисленных выше факторов.
Реорганизация структур мозга и их связей у рано ослепших лиц показана с использованием фМРТ и вычисления фракционной анизотропии [Multimodal MR-imaging reveals, 2017]. У слепых по сравнению со зрячей контрольной группой обнаружено уменьшение объема и толщины коры в затылочных и височных областях при увеличении теменных областей. У слепых также отмечено усиление связей лобных и височных областей, вовлеченных в речевые процессы. Этот эффект был представлен увеличением числа нервных волокон преимущественно в левом полушарии. Вместе с этим связность лобной и соматосенсорной, как и затылочной и сингулярной коры, снижалась [Hirsch, 2015].
При ранней слепоте реорганизация структур мозга приводит к дополнительному развитию слуховых, тактильных или обонятельных способностей и вследствие этого к лучшему распознаванию и запоминанию соответствующей информации, а также — к развитию на этой основе более сложных когнитивных функций: пространственной навигации, распознавания речи и вербальной памяти [Bubic, 2010; Merabet, 2010].
Таким образом среди специалистов, наряду с гипотезой о глобальном нарушении функций мозга при ранней сенсорной депривации, наблюдается тенденция к признанию тезиса об альтернативном компенсаторно-дополнительном развитии тех чувств, которые остались сохранными.
Действительно, реорганизация структур и систем мозга вследствие потери способности к обработке информации какой-либо одной модальности включает комплекс кросс-модальных, интра-модальных, мульти-модальных и супер-модальных изменений, обеспечивающих новые формы мультисенсорной интеграции поступающей информации, которая является базовым процессом работы мозга [Calvert, 2000; Crossmodal plasticity in, 2011].
Показано, например, что повышение тактильной чувствительности обеспечивает успешное усвоение чтения по Брайлю. Обнаруженное нарушение эффективности такого чтения, как и выполнения задания на генерацию глаголов вследствие транскортикальной магнитной стимуляции окципитальной коры, является доказательством кросс-модальной реорганизации функций этой части мозга.
Активация зрительных областей коры у слепых людей отмечена также при слуховом запоминании слов, причем эффективность такого запоминания выше, чем у зрячих людей, и коррелирует с уровнем такой активации [Bubic, 2010].
Нейронные структуры зрительной коры вовлекаются в различные процессы обработки слуховых стимулов: дискриминацию звуков, определение их пространственного расположения и движения, а также в организацию речи и вербальной памяти [Merabet, 2010]. Эффект вовлечения окципитальной коры в организацию речевых процессов и памяти у слепых людей сопровождается снижением ее функциональных связей с моторными и теменными областями коры, но повышением — с фронтальными речевыми зонами.
В литературе отмечается также возможность реорганизации связности зрительной и слуховой коры, так как выполнение слухового задания у рано ослепших лиц сопровождается повышением совместной активации в этих областях [State-dependent modulation of, 2017] или крупномасштабной реорганизацией корковых областей с потерей их сенсорной специализации для языковых или зрительных функций, обнаруженной в другом исследовании врожденной слепоты [A novel paradigm, 2018]. Изменения функциональной архитектуры задних отделов мозга у слепых показаны с использованием регистрации электрической активности коры при восприятии специально разделенных акустических и лингвистических характеристик речи. Установлено повышение синхронизации тета-осцилляций в парието-окципитальных областях коры в ответ на ритм речи независимо от ее содержания и синхронизации активности височных и затылочных областей соответственно пониманию речи [Neuronal populations in, 2018]. Следовательно, сети мозга, которые обычно предназначены для интеграции характеристик аудиовизуального речевого сигнала, могут быть реорганизованы в отсутствии визуальных стимулов с расширением речевой обработки в затылочной коре.
Формирование пространственной памяти включает изобразительный и описательный форматы. В первом случае репрезентация объекта основана на специфичных соотношениях его частей, а во втором — на словесном описании объекта для запоминания [Anatomical and functional, 2018]. Хорошо известна модель кратковременной памяти, предложенная А. Бэддели [Baddeley, 2010], которая включает три подсистемы: центральный исполнительный компонент, обеспечивающий доступ к сохраненной информации; фонологический цикл вербальной рабочей памяти и визуально-пространственная рабочая память. В связи с этим возникает вопрос, как представлена кратковременная память и мысленное представление у слепых?
Есть данные в пользу того, что слепые люди способны хранить и обрабатывать мысленные образы и представления пространственной информации, используя оставшиеся сенсорные модальности, чтобы заменить видение в процессах ментальных образов. Однако такие пространственные представления требуют больших затрат времени по сравнению со зрячими людьми, и эффективность пространственной памяти существенно снижается при увеличении сложности задания [Anatomical and functional, 2018; Shape perception and, 2017]. Прослушивание позволяет предоставлять сложную информацию, имеющую как семантический, так и несмысловой звуковой контент разной сложности содержания. Возникающие проблемы обусловлены тем, что слепые в большей степени фокусируются на расположение стимулов, чем на их содержание, а при понимании семантического смысла информации ускользает ее последовательность. Улучшение запоминания с использованием семантической информации происходит только тогда, когда на основе исследования удается сформировать целостное представление об окружающем пространстве. Еще одним фактором эффективности запоминания является используемая стратегия. Уже на ранних этапах развития зрительной системы происходит формирование пространственных координат объектов, и для запоминания расположения объектов используется аллоцентрическая стратегия, которая нарушается вследствие врожденной слепоты.
Интенсивное использование томографических методов исследования строения и функций мозга в последнее время позволило доказать, что следствием сенсорной депривации является атрофия как серого, так и белого вещества в зрительной коре слепых.
Однако наряду с общим снижением толщины зрительной коры при ранней слепоте в отдельных ее областях обнаруживается, напротив, увеличение толщины коры и содержания миелина. Эти нейроанатомические показатели предлагается рассматривать как маркеры компенсаторной нейропластичности в результате сенсорной депривации [Voss, 2019].
Вопрос о том, как формируются кросс-модальные связи коры и подкорковых структур у слепых лиц, вследствие образования новых или усиления уже имеющихся путей, пока еще остается открытым [Multimodal MR-imaging reveals, 2017; Voss, 2019].
Хотя возраст утраты зрения имеет существенное значение для кросс-модальной пластичности мозга и способов изменения процессов восприятия, необходимо отметить, что улучшение локализации звука наблю
далось и при ранней, и при поздней визуальной депривации, и даже при кратковременном нарушении («выпадении») зрения на несколько дней [King, 2015].
Реорганизация корковых областей происходит по-разному: и количественно, и качественно — в зависимости от времени потери зрения (стадии онтогенеза). Показано, например, что при врожденной слепоте формируются связи первичных зон слуховой и зрительной коры (рис. 1 А), а при поздней — через париетальные области (IPS на рис. 1 Б) [Impact of blindness, 2013].
Эффективность реорганизации коры и использования зрительных стратегий при поздней потере зрения зависит от степени развития зрительной системы вследствие ранее приобретенного опыта.
Механизмы такой гибкой перестройки функциональных связей при выключении одной из сенсорных систем пока не ясны. Имеются данные, свидетельствующие о том, что сензитивный период формирования кросс-модальной пластичности заканчивается к периоду полового созревания, или о возможностях реорганизации зрительной коры при более позднем наступлении слепоты [Bubic, 2010].
Несмотря на то, что сенсорная потеря вызывает нейропластичные изменения у всех людей, возраст возникновения нарушения влияет на тип, степень и механизмы этих изменений и, соответственно, на поведенческие результаты.
При этом даже эквивалентные функциональные результаты не обязательно поддерживаются одними и теми же базовыми механизмами.
Например, вовлечение затылочной коры в тактильную дискриминацию у недавно ослепших или зрячих, но с завязанными на неделю глазами [Merabet, 2010] может быть результатом активации уже существующих, но заторможенных в нормальных условиях функциональных связей зрительной коры.
Условия формирования таких «замаскированных» связей и их активации пока не ясны.
Следовательно, компенсаторные возможности разных популяций слепых людей нельзя рассматривать как эквивалентные, так как они принципиально зависимы от времени и условий повреждения зрительной системы. Изменчивость пластичности развития мозга и нейропластичности взрослого человека обязательно должна учитываться при разработке программ реабилитации отдельных физических лиц, в том числе с использованием сенсорного замещения.
Разработка и развитие интерфейсов «человек—компьютер» дает слепым новые возможности методов чтения и мобильности передвижения. Созданы разные системы зрительного замещения, основанные на принципах кросс-модального восприятия тактильных или слуховых сигналов [Stiles, 2015; Tactile-sight: A sensory, 2013]. На рис. 2 схематично представлены особенности такого сенсорного замещения для тактильного (рис. 2 А) и слухового (рис. 2 Б) восприятия.
Разработаны также электронные приборы с использованием акустического или оптического (лазерного луча) сигнала, которые позволяют передавать пространственную информацию о препятствиях и объектах в окружении через вибротактильные или слуховые сигналы [Bubic, 2010].
Функциональное значение нейропластичности для социальной адаптации продемонстрировано повышением реактивности билатерально фузиформной коры и правой части верхней височной извилины в ответ на голос, используемый для опознания других при врожденной слепоте [Plastic reorganization of, 2017].
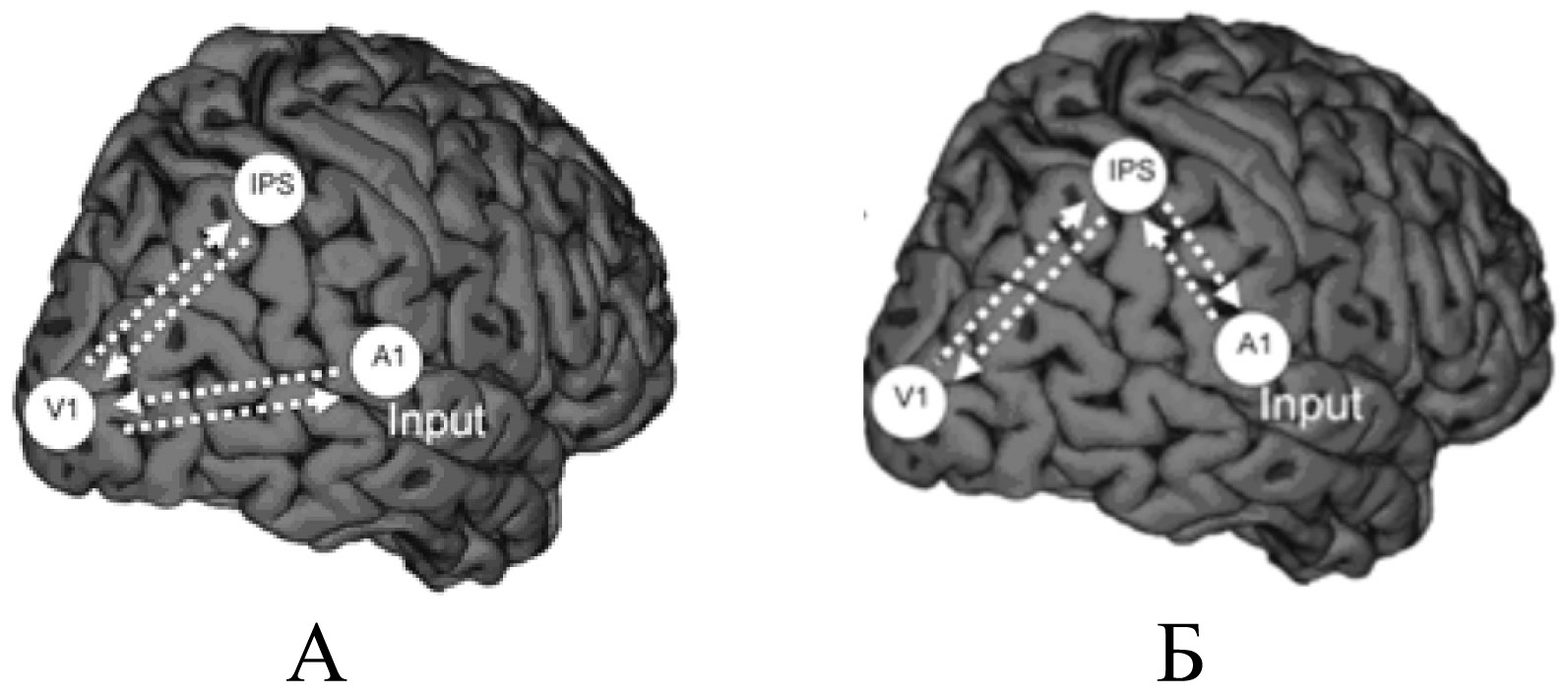
Рис. 1. Схематичное представление функционального взаимодействия первичных зон слуховой (A1) и зрительной (V1) коры при врожденной (А) и поздней (Б) слепоте [Impact of blindness, 2013]
При сохранном зрении эти области являются центральными в системе организации социального поведения с ориентацией на опознание лиц, включая эмоциональную экспрессию. Имеются также данные об усилении связей зрительной коры у слепых с фронтальными и париетальными областями коры, вовлеченными в организацию когнитивных функций. Вследствие этого наблюдаемую активацию окципитальных областей, вызванную выполнением слуховых заданий, связывают с исполнительным контролем внимания («top-down») у слепых людей [King, 2015].
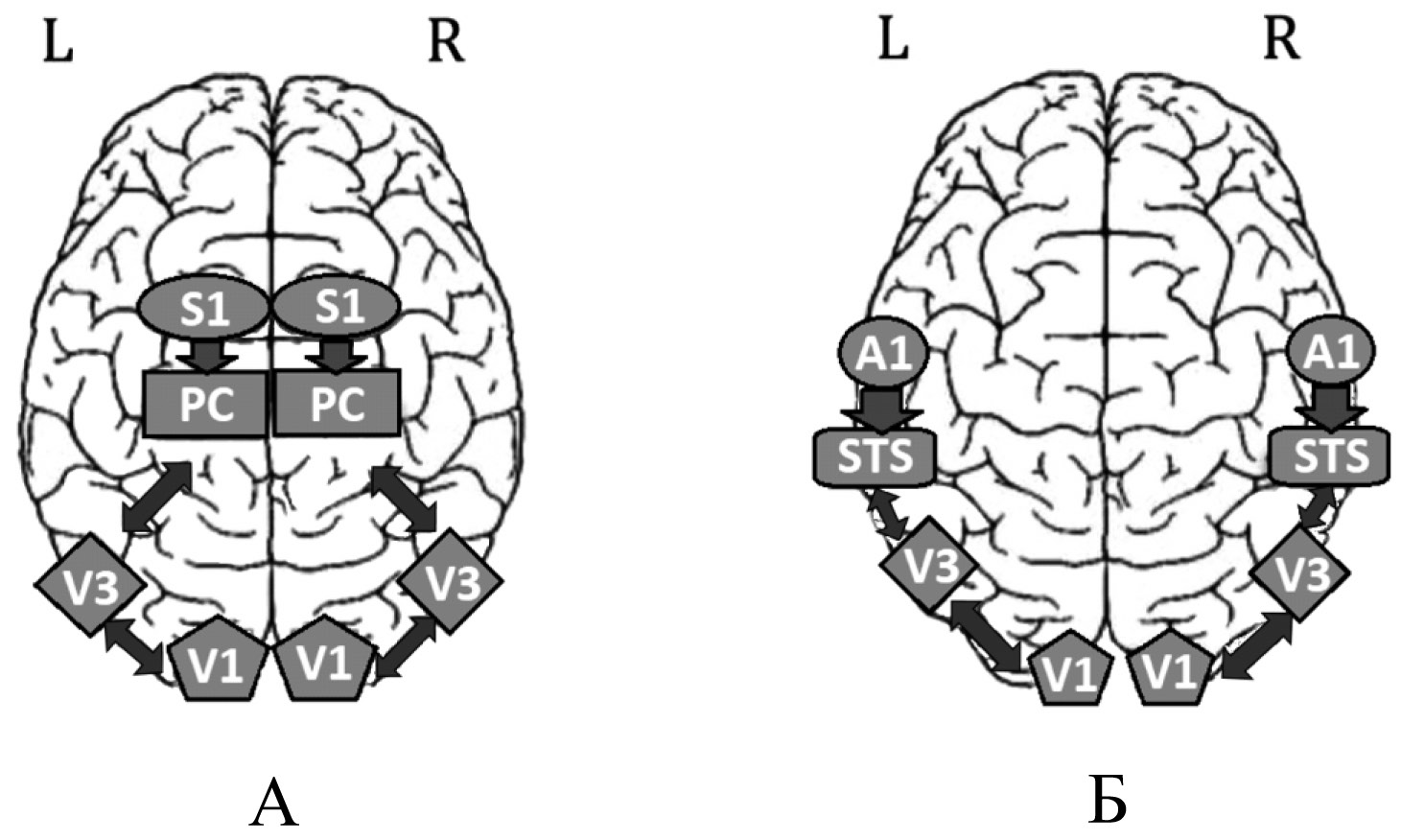
Рис. 2. Рис. 2. Схематичное представление тактильно-зрительного (А) и слухо-зрительного замещения (Б) [Stiles, 2015]:
V1, V3 — первичные и ассоциативные зрительные поля, соответственно; S1 — устройство тактильного восприятия коры;
A1 — устройство слухового восприятия; PC и STS — теменная и височные области коры
Механизмы кросс-модальной реорганизации сенсорных систем остаются актуальным направлением изучения закономерностей функциональной активности мозга в связи с невыясненными пока вопросами о том, как развиваются компенсаторные процессы при более поздней потере зрения или слуха, или восстановлении после лечения.
Какова временная динамика этих процессов: начального периода поражения системы, длительности патологического состояния и скорости восстановления?
Еще один важный вопрос — объяснение индивидуальной вариабельности нейропластичности: какими факторами она объясняется, и какие когнитивные и поведенческие реакции могут быть компенсированы вследствие использования ресурсов мозга.
Компенсаторные ресурсы мозга при сенсорной
депривации в слуховой системе
Согласно данным ВОЗ, в мире около 278 миллионов человек страдают умеренной или глубокой двусторонней потерей слуха (глубокая потеря слуха определяется как неспособность отреагировать на тон с частотой 90 дБ или больше) [Merabet, 2010].
Этиология глухоты разнообразна и включает как наследственные причины, так и травмы или инфекции. При старении может развиваться «двойная» сенсорная потеря: и слуха, и зрения.
Не только причинная, но и временная (начало и время развития) гетерогенность сенсорных нарушений создают значительные трудности в интерпретации экспериментальных данных. Специфичность выборки, т. е. воспитание в семьях глухих родителей и раннее усвоение языка жестов, является дополнительным фактором вариабельности в приспособлении сенсорных систем.
Кросс-модальная пластичность проявляется как реорганизация функциональных систем мозга при разных видах сенсорной депривации, в том числе при глухоте [Crossmodal plasticity in, 2011; Language and sensory, 2018], и затрагивает не только корковые области, но и таламокортикальные связи [Henscke, 2018].
Ыросс-модальная пластичность рассматривается, c одной стороны, как адаптивная вследствие использования улучшенных зрительных или слуховых навыков, соответственно у глухих или слепых людей. С другой стороны, кросс-модальная пластичность создает проблемы для сенсорного восстановления и воспринимается с позиций нейрореабилитации как неадаптивная, поэтому в перспективе улучшения конечных результатов адаптации предлагается учитывать взаимное дополнение нейронной специализации и нейронной пластичности [Heimler, 2014].
Эта проблема актуальна, например, при восстановлении слуха с помощью кохлеарных имплантов, так как имеется ряд доказательств того, что слуховая депривация сопровождается кросс-модальной пластичностью не только в организации зрительных путей к слуховой коре, преимущественно правого полушария [Dewey R.S, 2015], но и самой реорганизацией слуховой коры. Это заключение основано на данных о том, что функциональная активация была отмечена в одних и тех же областях коры при реализации зрительной версии задания у глухих и слуховой версии у лиц с нормальным слухом [Szwed, 2017], или в слуховой коре — в ответ на зрительную или соматосенсорную стимуляцию [Karns, 2012].
Вместе с этим после восстановления слуха у детей на основе кохлеарных имплантов вызванная речью активность была отмечена в слуховой коре [Neuroimaging with near-infrared, 2010].
Хорошо известно, что понимание речи требует интеграции слуховой и зрительной информации [Calvert, 2000].
Лица с дефицитом слуха при звуковой стимуляции демонстрируют повышенную активность в областях коры, специализированных для обработки зрительной информации [Visual activity predicts, 2013]. Глухие лучше, чем слышащие, способны распознавать черты лица и эмоциональную экспрессию [Merabet, 2010]. У них также повышается эффективность периферического зрения, причем лучшие способности детекции зрительных стимулов и их дискриминации характерны при предъявлении информации в правое зрительное поле.
Такое преимущество левого полушария рассматривается специалистами в качестве компенсаторного эффекта, относящегося к организации специализированных областей коры как речевых центров при невозможности такой специализации у глухих.
В сравнении со слепыми, у глухих отмечена меньшая степень морфологических изменений в оставшихся интактными сенсорных зонах мозга [Merabet, 2010].
Однако имеются доказательства вовлечения слуховых областей коры в обработку вибротактильных и зрительных стимулов, связанных с речевой деятельностью на основе жестов. С использованием томографических методов было показано большее участие окципитальных и париетальных участков коры в процессах внимания глухих по сравнению со слышащими.
Исследования клинических случаев, описывающие особенности жестового языка глухих пациентов, свидетельствуют, что поражения левых височных областей коры приводят к нарушениям понимания языка жестов, согласующихся с представлением о локализации речевых функций слышащих [Merabet, 2010].
Имеется сообщение о «жестовой слепоте» глухого после повреждения левой затылочной коры с нарушением понимания, но не воспроизведения жестов, аналогичное алексии. У другого пациента при сходном поражении мозга была отмечена афазия на языке жестов с серьезными нарушениями не только понимания, но и производства слов, а также чтения и письма.
Анализ результатов процедуры реабилитации показал снижение активности слуховой и речевой систем при ее повышении в зрительной и фронтальной областях коры с расширением на мультимодальные области, такие как верхняя височная извилина, интрапариетальная борозда и инсула, толщина коры в которых увеличивалась после использования слухового аппарата в течение года [Atilgan, 2017].
Таким образом, реорганизация специализированных слуховых височных областей и зрительных затылочных имеет решающее значение для развития речи глухих. Нейропластичность мозга особенно высока на ранних этапах развития. Поэтому чем раньше будет диагностирована глухота и применены кохлеарные импланты, тем эффективнее будет происходить формирование речевых функций на основе кросс- модальной реорганизации функциональных систем мозга. Сенсорный дефицит раннего периода может быть компенсирован вследствие интенсивного перцептивного и поведенческого обучения [Zhou, 2009].
Учитывая повышение вероятности потери зрения или слуха при старении, факт влияния когнитивной тренировки, как и подтверждение потенциала нейропластичности у взрослых [Fuchs, 2014], указывает на перспективы дальнейшего изучения механизмов реализации компенсаторных возможностей мозга.
Поздняя потеря слуха, отмеченная в 25—46% случаев в возрасте 65—74 лет и в 78-80% у лиц старше 75 лет [Cardon, 2018] представляет отдельную проблему. И в этом случае отмечена кросс-модальная реорганизация слуховой и соматосенсорной коры головного мозга, связанная с восприятием речи.
Дети с потерей слуха потенциально уязвимы в отношении психического здоровья [Emotional and behaviour, 2017]. Повышение риска развития эмоциональных и поведенческих проблем, по сравнению с детьми в общей популяции, обусловлено суммацией воздействия ряда факторов: дефицит в усвоении речи влечет за собой трудности в общении, приобретении навыков чтения и, в целом, проблемы в развитии когнитивных способностей и формировании структуры знаний [Predicting reading ability, 2018].
Особую группу для понимания механизмов кросс- модальной реорганизации представляют лица с мультимодальными сенсорными нарушениями. При потере зрения и слуха тактильные ощущения остаются единственным каналом восприятия пространства и освоения речи. Обнаружено, что идентификация тактильно предъявленных слов ассоциируется с активацией зрительной и слуховой речевых областей мозга, подтверждая возможности нейропластичной адаптации нервной системы [Neuroplasticity associated with, 2009].
Восприятие и обработка информации в первичной слуховой коре находятся под сильным мультимодальным воздействием. Вследствие этого при обучении формируются ассоциативные связи, основанные на классификации сигналов по признакам их обнаружения, дискриминации и категоризации [Behavioral semantics of, 2011]. Эта иерархия классификаций определяет семантические «одинаковые» отношения между звуками и на основе различных возбуждающих и тормозных механизмов формирует пространственно-временную метрику карты для представления звука. Следовательно, слуховая кора, собирая всю необходимую информацию, функционирует как «семантический процессор», присваивая конкретное значение звукам посредством обучения. При отсутствии звуковых сигналов семантическое картирование может осуществляться с использованием кросс-модальной обработки информации.
Заключение
Обзор литературы позволяет заключить, что депривация зрительных или слуховых сигналов приводит к кросс-модальной перестройке механизма обработки информации с вовлечением в процесс непредназначенных для этого в норме нейронных структур мозга.
Нейронная пластичность особенно высока в ранние сензитивные периоды структурной специализации отдельных областей мозга. Вследствие этого при врожденной потере зрения или слуха развитие когнитивных функций опирается на имеющиеся нейронные ресурсы мозга и организацию новых функциональных систем для обработки поступающей информации. Информационно обогащенная среда в ранний период жизни позволяет создать многочисленные нейронные связи и, вследствие этого, функционально «гибкие» нейронные системы, которые, с одной стороны, являются основой кросс-модального замещения утерянной сенсорной функции, а с другой — резервным потенциалом мозга при старении и патологическом или травматическом его повреждении в зрелом возрасте. При отсутствии вариативности в окружающей среде кросс- модальная нейропластичность может становиться дезадаптивным фактором, так как приводит к формированию настолько устойчивой мультисенсорной реорганизации нейронных систем, которая препятствует их дальнейшим изменениям вследствие применения технических или психолого-педагогических средств реабилитации. Однако мультимодальный принцип обработки информации, присущий мозгу, создает потенциальные возможности дополнительного развития его нейронных систем при настойчивом обучении и мультисенсорной тренировке когнитивных функций, что, в конечном счете, способствует успешной адаптации.
Поэтому поиск конкретных нейрофизиологических или психометрических показателей эффективности формирования и динамики реализации компенсаторных резервов в зависимости от особенностей сенсорной депривации, в том числе — ее этиологии и возрастной периодизации, несмотря на описанные выше выявленные закономерности нейропластичности при потере зрения или слуха, остается актуальным направлением дальнейших исследований в нейропсихологии.