ВВЕДЕНИЕ
Дифференциальная диагностика рекуррентных и биполярных депрессий, т.е. депрессивных эпизодов при рекуррентном депрессивном расстройстве (РДР) и биполярном аффективном расстройстве (БАР) представляет определенные трудности в практике, несмотря на некоторые очевидные клинические особенности и различия [1, 2]. Так, например, в опубликованных Минздравом России клинических рекомендациях 2021 г. по диагностике и терапии БАР [3] указано, что критерии депрессивного эпизода при БАР и РДР не различаются, однако, для депрессии при БАР более характерны такие признаки, как начало в более молодом возрасте (до 25 лет) или в послеродовый период, острое начало (дни или часы) симптоматики и ее быстрое завершение, черты атипичной депрессии с гиперфагией, гиперсомнией, инвертированной суточной ритмикой и т.д., наличие психотической симптоматики, затяжной характер течения, низкая чувствительность к терапии антидепрессантами. Тем не менее, в клинической практике указанные выше признаки атипии депрессивного эпизода при БАР выявляются далеко не во всех случаях [4, 5]. Между тем, дифференциация рекуррентной и биполярной депрессии имеет огромное значение для выбора терапии. В связи с отсутствием надежных клинических критериев, особую роль могут сыграть нейробиологические характеристики депрессивных состояний. Однако в настоящее время успехи в исследованиях такого рода относительно скромны, а в ряде случаев экономически необоснованны [6–9].
Одной из задач клинических нейрофизиологических исследований является поиск надежных маркеров, которые могли бы не только выявлять изменения в функционировании нервной системы при различных заболеваниях, но и способствовать объективной диагностике самих заболеваний, в т.ч. и дифференциальной диагностике. Для решения данной задачи наиболее перспективным инструментом является электроэнцефалография (ЭЭГ). Это неинвазивный, недорогой и объективный метод регистрации нейронной активности головного мозга (ГМ). В отличие от нейровизуализационных методов исследования, ЭЭГ обеспечивает непрерывную оценку нейронной активности, связанной со стимулом или реакцией с высоким временным разрешением, даже если не наблюдается никаких внешних изменений в поведении. Следовательно, параметры ЭЭГ могут быть полезны в качестве биологических маркеров психического заболевания, указывая на конкретные патофизиологические механизмы. К настоящему времени накоплены данные объективных исследований [10–12], в т.ч. результаты наших работ [13, 14], в которых предлагаются различные ЭЭГ-маркеры для дифференциации униполярной и биполярной депрессии. Тем не менее, вопрос об их валидности все еще остается открытым.
Согласно многочисленным данным, развитие депрессивных состояний сопровождается изменением структуры всех частотных диапазонов ЭЭГ [15–17]. В большей степени эти изменения касаются основного ритма ЭЭГ — альфа-ритма. Согласно исследованиям, генерация альфа-ритма связана с импульсной активностью по интеркортикальным и таламокортикальным нейронным сетям, а выраженность его обуславливает синхронизацию функциональной активности ГМ и определяет связь получаемой информации от афферентной системы к механизмам оперативной памяти, регулируя адаптационные процессы организма [18, 19]. Поэтому альфа- диапазон ЭЭГ традиционно привлекает внимание исследователей, благодаря его высокой чувствительности к разнообразным внешним воздействиям и тонким изменениям функционального состояния коры ГМ. Между тем, и нейрофизиологические механизмы, и функциональное значение альфа- ритма до сих пор остаются предметом дискуссий. В ряде работ подчеркнуто, что для полного понимания количественных характеристик альфа-ритма требуется учитывать спектральную мощность и выраженность реакции активации (подавление альфа- ритма при открывании глаз, эффект Бергера) [18, 19]. На сегодняшний день существуют обширные данные по вопросам изменения мощности альфа-ритма при депрессивных расстройствах различного генеза [10–17]. Однако исследования реакции активации у пациентов с депрессивными расстройствами в литературе исчисляются единицами [20].
Цель исследования — выявить различия количественных параметров альфа-ритма ЭЭГ у пациентов с депрессивным эпизодом в рамках РДР и БАР.
МЕТОДЫ
Условия проведения исследования
Отбор пациентов для исследования проводился на базе 3–го клинического психиатрического отделения (отделение аффективных состояний) клиники НИИ психического здоровья Томского НИМЦ. Проведение ЭЭГ исследования осуществлялось в лаборатории молекулярной генетики и биохимии НИИ психического здоровья Томского НИМЦ.
Формирование выборки и отбор участников
Всего в рамках данного исследования было обследовано 60 пациентов — женщин (возраст в годах: медиана — 32, межквартильный размах — 27 и 53), поступивших на лечение с диагнозом из кластера Расстройств настроения: РДР, текущий эпизод легкой/средней степени тяжести (F33.0, F33.1 по МКБ-10, n=30) и БАР, текущий эпизод легкой или умеренной депрессии (F31.3 по МКБ-10, n=30). Диагностическая оценка и клиническая квалификация расстройства осуществлена психиатрами согласно критериям МКБ-10, а также с помощью психометрической шкалы депрессии Гамильтона (The Hamilton Rating Scale for Depression, сокращенно HDRS-17) для оценки тяжести текущей симптоматики. Для составления катамнеза учитывался возраст пациентов, продолжительность заболевания в годах, общее количество депрессивных эпизодов и продолжительность текущего эпизода в месяцах.
Критерии включения в исследование: согласие пациента на исследование, установленный диагноз аффективного расстройства (F31.3 или F33.0-1) по МКБ-10, возраст 18–60 лет.
Критерии исключения: отказ от участия в исследовании, деменция, умственная отсталость, другие тяжелые органические заболевания ГМ с выраженными когнитивными нарушениями (энцефалиты, менингиты, последствия ЧМТ, и др.), острые или хронические декомпенсированные соматические заболевания, требующие интенсивного терапевтического вмешательства.
Все пациенты были обследованы при госпитализации (до начала основного курса терапии), как правило, на 2–3-е сутки поступления в стационар.
В качестве контрольной группы было обследовано 30 психически и соматически здоровых женщин (возраст в годах: медиана — 35, межквартильный размах — 25 и 53) с аналогичными критериями исключения (Критерий Краскела-Уоллиса (2, N=90)=6,689, p=0,158 при сравнении между группами РДР, БАР и контроля).
Процедура записи и обработки ЭЭГ
Проведение ЭЭГ осуществлялось в электрически экранированной комнате с приглушенным светом. Пациенты во время исследования находились в состоянии спокойного расслабленного бодрствования, в положении сидя. Было проведено две функциональные пробы: фон с закрытыми глазами и проба с открытыми глазами. Все пациенты в течение записи ЭЭГ находились под наблюдением врача, и в случае выявления признаков засыпания или ЭЭГ-признаков сонливости запись прекращалась. ЭЭГ записывали с помощью 16-канального энцефалографа (Неврополиграф, ООО «Неврокор», г. Москва) по международной системе 10–20%, монополярно, с частотой дискретизации 1 кГц и Fz в качестве электрода заземления. Референтные электроды (А1 и А2) накладывали на мочки ушей.
Длительность записи ЭЭГ составила в среднем 5 минут. Полученные ЭЭГ подвергалась полосовой фильтрации в диапазоне от 1 до 40 Гц. Сначала каждая ЭЭГ очищалась от артефактов (баллистокардиограмма, окулографические и электромиграфические потенциалы) на основе визуальной оценки квалифицированным врачом функциональной диагностики. Очищенная запись ЭЭГ подвергалась количественному анализу с помощью пакета программы «Неврополиграф». Проводилось построение топографических карт альфа-спектра для отображения градиентных изменений максимумов альфа-ритма: область доминирования — отделы мозга с максимальной амплитудой (как правило, в затылочных отделах); сохранность зональных различий — в выраженности альфа- ритма в отведениях; оценка лобно-затылочного градиента — снижение выраженности альфа-ритма oт затылочных отведений к лобным. Рассчитывались усредненные по всем отведениям ЭЭГ значения абсолютной спектральной мощности (мкВ2) и межполушарной когерентности (СрКОГ) альфа-ритма в стандартном частотном диапазоне (8–13 Гц) при закрытых и открытых глазах. Силу реакции активации (эффект Бергера) определяли по формуле:
где Rа — сила реакции активации; Rзг и Rог — усредненная по всем отведениям ЭЭГ спектральная мощность альфа-ритма при закрытых и открытых глазах, мкВ2.
Статистический анализ
Статистическая обработка полученных данных осуществлялась с помощью пакета программы Statistica 12 (StatSoft). Проверка на согласие с законом нормального распределения осуществлялась с помощью критерия Шапиро–Уилка. Полученные данные не подчинялись закону нормального распределения. Данные представлены в виде медианы и межквартильного размаха Me [Q1; Q3]. При сравнении социально-демографических и клинических характеристик между двумя группами пациентов использовался критерий Манна–Уитни. При сравнении количественных характеристик альфа-ритма между контролем и группами пациентов использовался критерий Краскела–Уоллиса ANOVA с процедурой автоматического апостериорного попарного сравнения с помощью теста Данна. Для оценки наличия, уровня и направленности корреляций социально-демографических, клинических и ЭЭГ показателей применялся критерий ранговой корреляции Спирмена. Различия считались статистически значимыми при р <0,05.
Правовой и этический контроль за проведением исследования
Исследование было проведено с соблюдением всех принципов Хельсинкской декларации 1964 г. с поправками в 1975–2013 гг. и одобрено локальным этическим комитетом при НИИ психического здоровья Томского НИМЦ (протокол № 154 от 17.06.2022, дело № 154/1.20.22). Все обследуемые пациенты дали письменное информированное согласие на участие в исследовании и обработку персональных данных.
РЕЗУЛЬТАТЫ
Социально-демографические и клинические характеристики пациентов приведены в табл. 1.
Таблица 1. Социально–демографическая и клиническая характеристика пациентов
|
Параметр |
Пациенты с БАР, n=30 |
Пациенты с РДР, n=30 |
U |
р |
|
Возраст в годах |
36 [23; 53] |
37 [26; 52] |
1819 |
0,749 |
|
Длительность заболевания в годах |
7 [4; 13] |
7 [3; 11] |
1763 |
0,381 |
|
Длительность текущего эпизода в месяцах |
6 [3; 10] |
3 [2; 8] |
1597 |
0,137 |
|
Количество предыдущих эпизодов |
3 [2; 7] |
4 [3; 8] |
1711 |
0,501 |
|
Общий балл по HDRS-17 |
19 [16; 24] |
20 [17; 25] |
1608 |
0,277 |
Примечание: р — уровень статистической значимости при сравнении групп с помощью критерия Манна-Уитни.
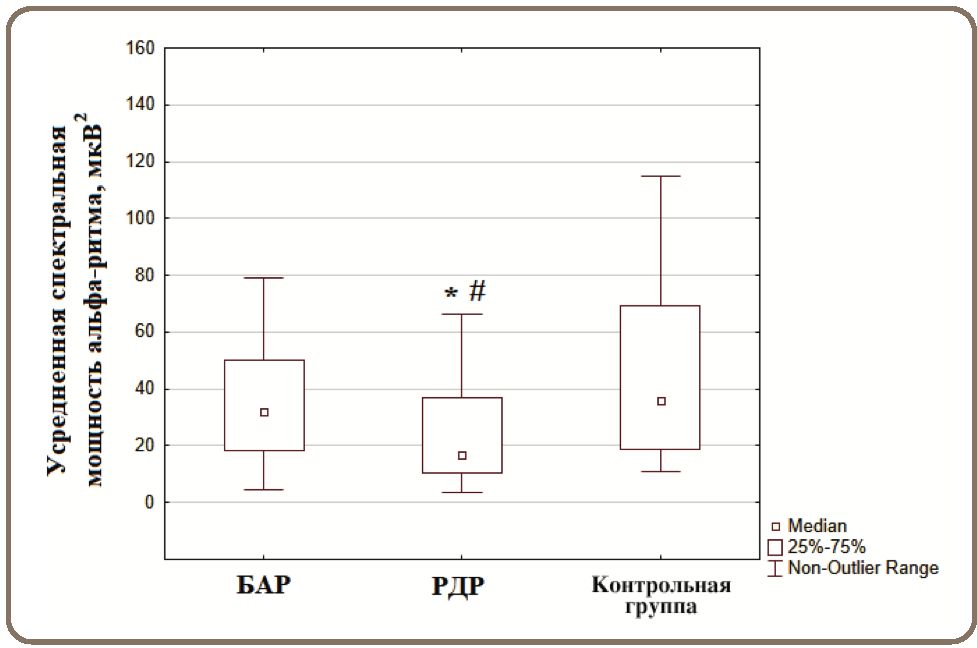
Сравнительный анализ усредненных показателей абсолютной спектральной мощности альфа- ритма ЭЭГ между контрольной группой и пациентами с БАР и РДР выявил статистически значимые различия. Особенность больных с РДР заключалась в редукции альфа-ритма относительно контрольной группы (z=3,223; p=0,003) и пациентов с БАР (z=2,399; p=0,042). Статистически значимых различий между больными с БАР и контрольной группой нам обнаружить не удалось (z=0,976; р=0,986) (рис. 1).
Рисунок 1. Усредненные значения спектральной мощности альфа-ритма в исследуемых группах здоровых лиц и пациентов с БАР и РДР.
Примечание: * статистически значимые различия при р <0,05 между группой больных с РДР и контролем, # статистически значимые различия при р <0,05 между группой больных с РДР и БАР с использованием критерия Краскела–Уоллиса ANOVA.
Показатель срКОГ альфа-ритма между исследуемыми группами выявил выраженное снижение (z >7,121; р <0,001) связей у всех пациентов по сравнению с контролем (рис. 2). Статистически значимых различий между пациентами с БАР и РДР обнаружено не было (z =0,951; р=0,961).
Рисунок 2. Усредненные значения межполушарной когерентности альфа-ритма в исследуемых группах здоровых лиц и пациентов с БАР и РДР.
Примечание: * статистически значимые различия при р <0,05 между группой контроля и пациентами с БАР и РДР с использованием критерия Краскела–Уоллиса ANOVA, ** срКОГ — это усредненная межполушарная когерентность (не имеет размерности).
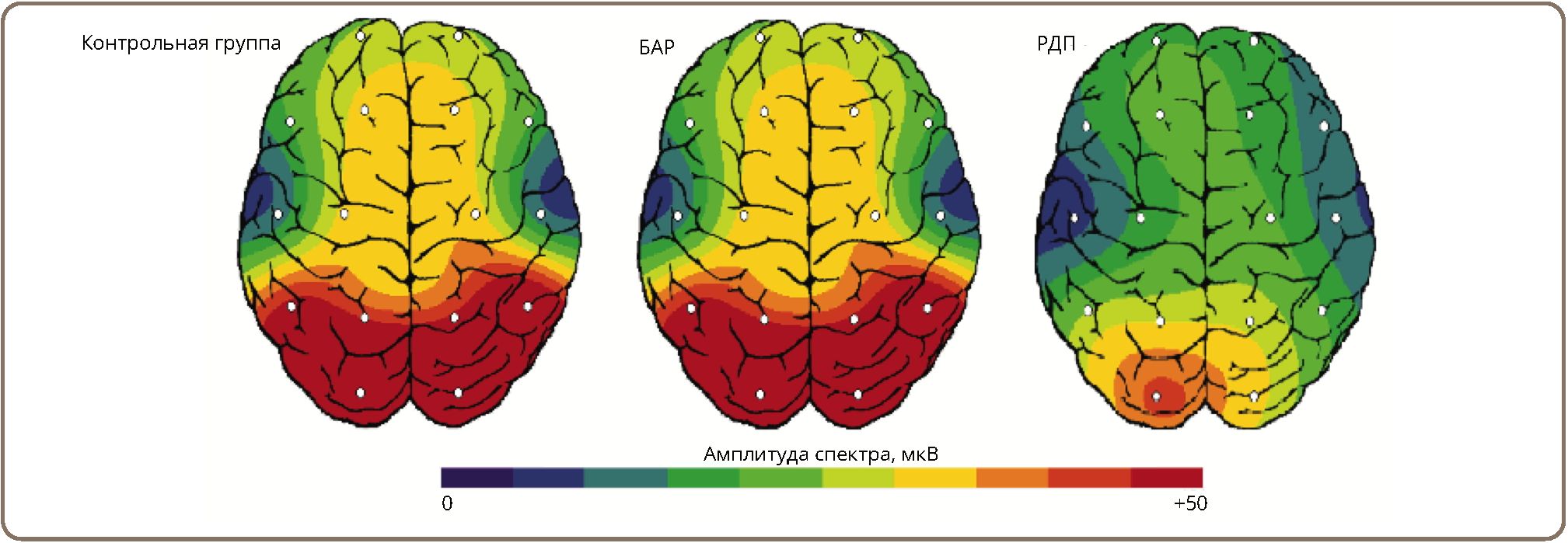
По данным визуальной оценки ЭЭГ (рис. 3) снижение генерации альфа-ритма у больных с РДР приводило к уменьшению лобно-затылочного градиента и сглаживанию зональных различий ЭЭГ. Однако на ЭЭГ больных с РДР наиболее высокие значения альфа-ритма в затылочных областях сохранялись. Топографическая карта распределения альфа-ритма у больных с БАР была схожа с контрольной группой.
Рисунок 3. Топографические карты распределения альфа-спектра в контрольной группе и у пациентов с БАР и РДР.
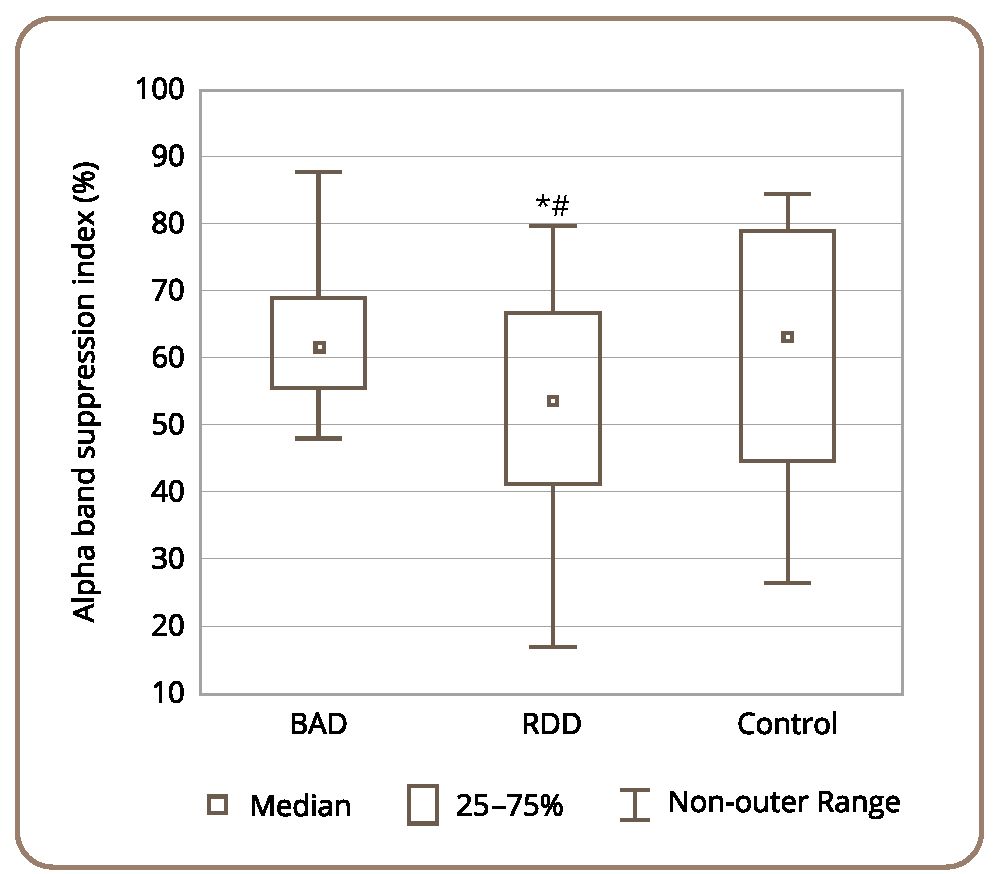
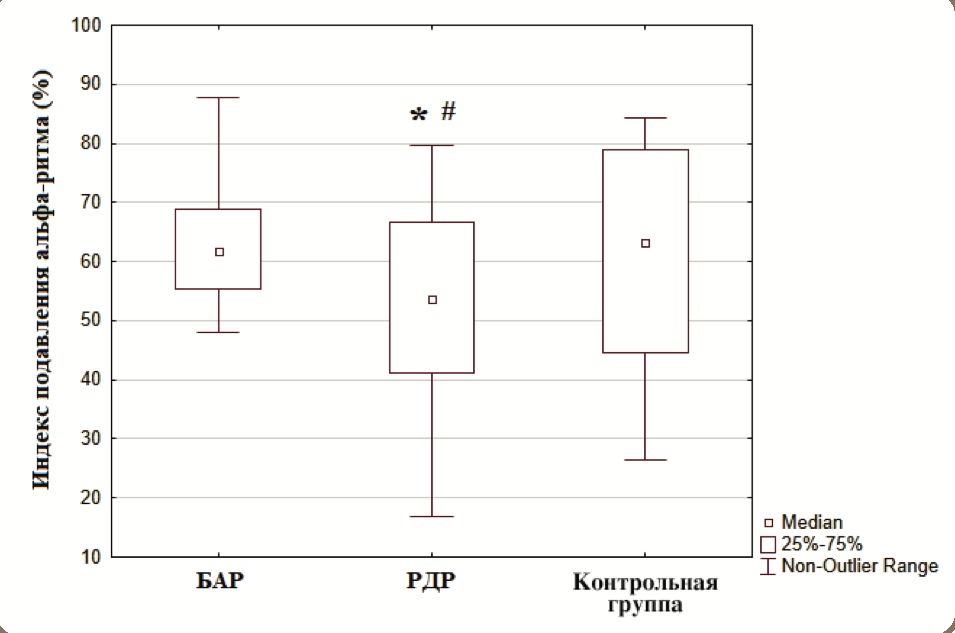
Степень депрессии альфа-ритма при открывании глаз (эффект Бергера) статистически значимо оказалась ниже в группе пациентов с РДР по сравнению с контролем (z=2,481; р=0,042) и пациентами с БАР (z=2,573; p=0,035) (рис. 4). Статистически значимых различий между больными с БАР и группой контроля нам также обнаружить не удалось (z=0,442; р=0,991).
Рисунок 4. Усредненные индексы подавления альфа-ритма (%) при открывании глаз в исследуемых группах здоровых лиц и пациентов с БАР и РДР.
Примечание: * статистически значимые различия при р <0,05 между группой больных с РДР и контролем, # статистически значимые различия при р <0,05 между группой больных с РДР и БАР с использованием критерия Краскела–Уоллиса ANOVA.
Статистически значимых корреляций спектральной мощности, срКОГ альфа-ритма и реакции активации с возрастом и клиническими характеристиками пациентов нам обнаружить не удалось ни в одной из групп (р >0,05) (табл. S1 и S2 Приложения).
ОБСУЖДЕНИЕ
В представленном исследовании была проведена оценка количественных характеристик альфа-ритма ЭЭГ у больных БАР и РДР с текущим депрессивным эпизодом легкой/умеренной степени тяжести. Были оценены как неспецифические физические параметры волнового процесса (мощность и когерентность), так и физиологические особенности альфа- осцилляций (реактивность на зрительную стимуляцию при открывании глаз).
Согласно полученным результатам, исследуемые группы больных имели свои отличительные электро- физиологические особенности. В частности, пациенты с РДР отличались низкими значениями абсолютной спектральной мощности альфа-ритма, а также имели менее выраженную реакцию активации по сравнению с пациентами с БАР. Согласно современным представлениям, в основе генерации ЭЭГ лежат нейрофизиологические механизмы возбуждения и торможения [22]. С одной стороны, низкие значения альфа-мощности свидетельствуют об усилении процессов возбуждения в центральной нервной системе (ЦНС) у пациентов с РДР по сравнению с БАР. С другой стороны, низкие показатели спектральной мощности альфа-ритма у больных с РДР указывают на меньшую синхронизацию (дисфункцию) таламокортикальных связей [22], что дополнительно подтверждает сниженный относительно контроля показатель СрКОГ.
Снижение мощности альфа-волн в ответ на открывание глаз (эффект Бергера), является одним из информативных признаков стабильности реакции активации и вместе с выраженностью десинхронизации (% депрессии альфа-ритма) соотносится с процессом переработки информации [18, 23], отражающим переход из состояния относительного покоя к состоянию деятельности. Глубина снижения альфа-мощности коррелирует с интенсивностью процессов активации. Таким образом, пациенты с РДР отличались снижением интенсивности процессов активации относительно здоровой группы контроля и пациентов с БАР. При этом у пациентов с БАР сила реакции активации соответствовала контрольной группе.
Таким образом, исследование альфа-ритма ЭЭГ с применением спектрального и когерентного анализа позволило выявить у больных с БАР и РДР особую мозаику биоэлектрической активности мозга, что возможно в дальнейшем позволит дифференцировано подходить к оценке функциональной активности ГМ при первом депрессивном эпизоде на основании количественных показателей альфа-ритма.
Помимо поиска различий характеристик альфа- ритма между группами пациентов, нами также была проведена оценка корреляций показателей альфа- ритма с клиническими данными. Однако нам не удалось обнаружить статистически значимых корреляций. Возможно, это связано с тем, что субклинические проявления депрессии в обеих группах, требуют более тонкого феноменологического анализа, чем длительность заболевания/эпизода и шкала Гамильтона.
Основным ограничением нашей работы является относительно небольшое количество исследуемых лиц и отсутствие мужчин в каждой группе. Однако стоит отметить, что мы стремились к сбалансированности групп по социально-демографическим и клиническим данным. Еще одним ограничением исследования является то, что хотя нами оценены как неспецифические физические параметры волнового процесса, так и физиологические особенности альфа-осцилляций, выбранные количественные характеристики альфа- ритма далеко не полно описывают все возможности количественной оценки ЭЭГ. Количественные параметры альфа-ритма весьма разнообразны и далеко не ограничены линейными методами исследования [24]. В отличие от других исследований [11, 12, 16, 19, 20, 24], наш анализ сводит к минимуму межрегиональные различия, используя усредненные показатели спектральной мощности и когерентности альфа-ритма ЭЭГ. Однако такой подход вполне оправдан и применяется во многих исследованиях [25, 26]. Несмотря на то, что пациенты были обследованы при госпитализации (до начала основного курса терапии), мы не учитывали эффект влияния поддерживающей терапии, которая вполне могла оказать влияние на ЭЭГ, что также является ограничением исследования.
ЗАКЛЮЧЕНИЕ
Полученные результаты уточняют и расширяют имеющиеся данные об особенностях функциональной активности ГМ больных с аффективными расстройствами. Выявленные межгрупповые различия среди исследуемых больных могут послужить основой для дальнейшего поиска биомаркеров с целью разделения рекуррентной и биполярной депрессии. Увеличение групп испытуемых, а также включение в выборку мужчин в дальнейших исследованиях покажет, были ли эти различия случайным эффектом, который нередко проявляется в относительно небольших группах.
Вклад авторов: Н.А. Бохан: разработка идеи, постановка задач исследования, обсуждение результатов и формирование выводов; С.А. Галкин: разработка дизайна исследования, получение данных для анализа, анализ полученных данных, написание текста рукописи; С.Н. Васильева: получение данных для анализа. Все авторы внесли существенный вклад в проведение исследования и подготовку статьи, прочли и одобрили финальную версию до публикации.