ВВЕДЕНИЕ
Во всем мире, включая Россию, число людей, зависимых от психоактивных веществ, стремительно растет [1, 2]. Согласно информации Всемирной организации здравоохранения, злоупотребление алкоголем, наркотиками и другими веществами, влияющими на сознание, стало эпидемией в начале XXI века [3, 4]. Следует добавить, что число проблемных семей, сталкивающихся с зависимостью и требующих квалифицированной и своевременной помощи, также увеличивается [5]. Индивидуальные различия в склонности к аддиктивному поведению, в том числе никотиновой зависимости, частично опосредованы генетическими факторами [6]. Текущие оценки наследуемости всех основных аддиктивных расстройств варьируют от 40 до 80% [7].
Аддиктивное поведение (от англ. addiction — «зависимость») — это одна из форм отклоняющегося поведения, которая возникает в результате стремления избежать реальности [8]. Наличие аддиктивного поведения указывает на нарушенную адаптацию к измененным условиям окружающей среды [9]. К аддиктивному поведению традиционно относят алкоголизм, наркоманию, токсикоманию, табакокурение (химические зависимости), а также компьютерную зависимость, азартные игры, любовные зависимости, сексуальные зависимости, работоголизм и аддикцию к еде (переедание, голодание) [10]. Расстройства, связанные с употреблением психоактивных веществ, являются наиболее распространенными и серьезными формами зависимости, включенными в Международную классификацию болезней 10-го пересмотра (МКБ-10) как классы F10–F19 «Психические расстройства и расстройства поведения, связанные с употреблением психоактивных веществ» [11].
Такие функции, как настроение, эмоции, познание, двигательные способности, а также циркадные и нейроэндокринные ритмы, включая аппетит, сон и репродуктивную активность, регулируются системой серотонина в средней части мозга [12]. Изменение содержания серотонина выступает в качестве одного из эффектов аддиктивного поведения, обусловливает значимость генов, кодирующих рецепторы и транспортеры серотонинергических путей, в патогенезе формирования зависимости [13]. Одним из генов-кандидатов, влияющих на развитие зависимостей, является ген-переносчик серотонина SLC6A4 [10]. Недавние исследования показали, что вариант 5-HTTLPR (полиморфный участок, связанный с транспортером серотонина) в этом гене коррелирует с курением, однако уровень его влияния остается неопределенным из-за недостаточного количества исследований [10, 14].
Исследования патологического аллеля 5-HTTLPR гена SLC6A4 свидетельствуют о наличии связи между различными психическими расстройствами и уровнем транскрипционной активности аллелей S и L [15]. Так, например, сниженная активность аллеля S может быть ассоциирована с тревожностью, депрессией, суицидальными попытками и биполярным расстройством, в то время как повышенная активность аллеля L считается защитой от депрессии, но может быть связана с суицидальным поведением, никотиновой зависимостью и синдромом дефицита внимания и гиперактивности [15–17]. Указанные аллели также могут влиять на эффективность лечения: к примеру, ингибиторы обратного захвата серотонина могут оказаться более эффективными у пациентов с депрессией и посттравматическим стрессовым расстройством, у которых есть аллели L [18]. В частности, носительство S-аллеля детерминирует высокий риск развития неблагоприятных исходов, ассоциированных с употреблением алкоголя, что опосредовано сниженной чувствительностью к этанолу [19].
Цель работы — оценить роль вариации 5-HTTLPR гена SLC6A4 серотонинергической системы в развитии аддиктивных расстройств.
МЕТОДЫ
Критерии соответствия
Критерии включения:
- оригинальные исследования и метаанализы, посвященные роли вариации 5-HTTLPR гена SLC6A4 в формировании аддиктивных расстройств, включая взаимодействие генетических и средовых факторов;
- публикации, анализирующие фармакогенетические аспекты применения антидепрессантов (селективных ингибиторов обратного захвата серотонина, СИОЗС) у носителей различных полиморфизмов 5-HTTLPR;
- исследования, рассматривающие этнические различия в распределении аллелей S и L и их связь с клиническими исходами.
Критерии исключения:
- клинические случаи и серии случаев без контрольных групп;
- статьи, посвященные исключительно терапии аддиктивных расстройств без анализа генетических факторов;
- публикации на языках, отличных от русского и английского.
Источники информации
Поиск литературы проводился в электронных базах данных MEDLINE и eLIBRARY.RU. Поиск был выполнен в декабре 2024 г.
Период поиска — с января 2003 г. по декабрь 2024 г. Поиск был ограничен 2003 г., поскольку именно в этом году были опубликованы первые фундаментальные исследования роли 5-HTTLPR [20], положившие начало изучению взаимодействия данного полиморфизма с психическими расстройствами и аддиктивным поведением.
Стратегия поиска
Для отбора публикаций использовали следующие комбинации ключевых слов на русском и английском языках: «SLC6A4», «5-HTTLPR», «аддиктивные расстройства», «фармакогенетика», «серотонин», «антидепрессанты», «этнические различия», «addictive disorders», «pharmacogenetics», «serotonin», «antidepressants», «ethnic differences». Поиск публикаций проводился поэтапно. Последовательность поиска представлена на рис. 1.
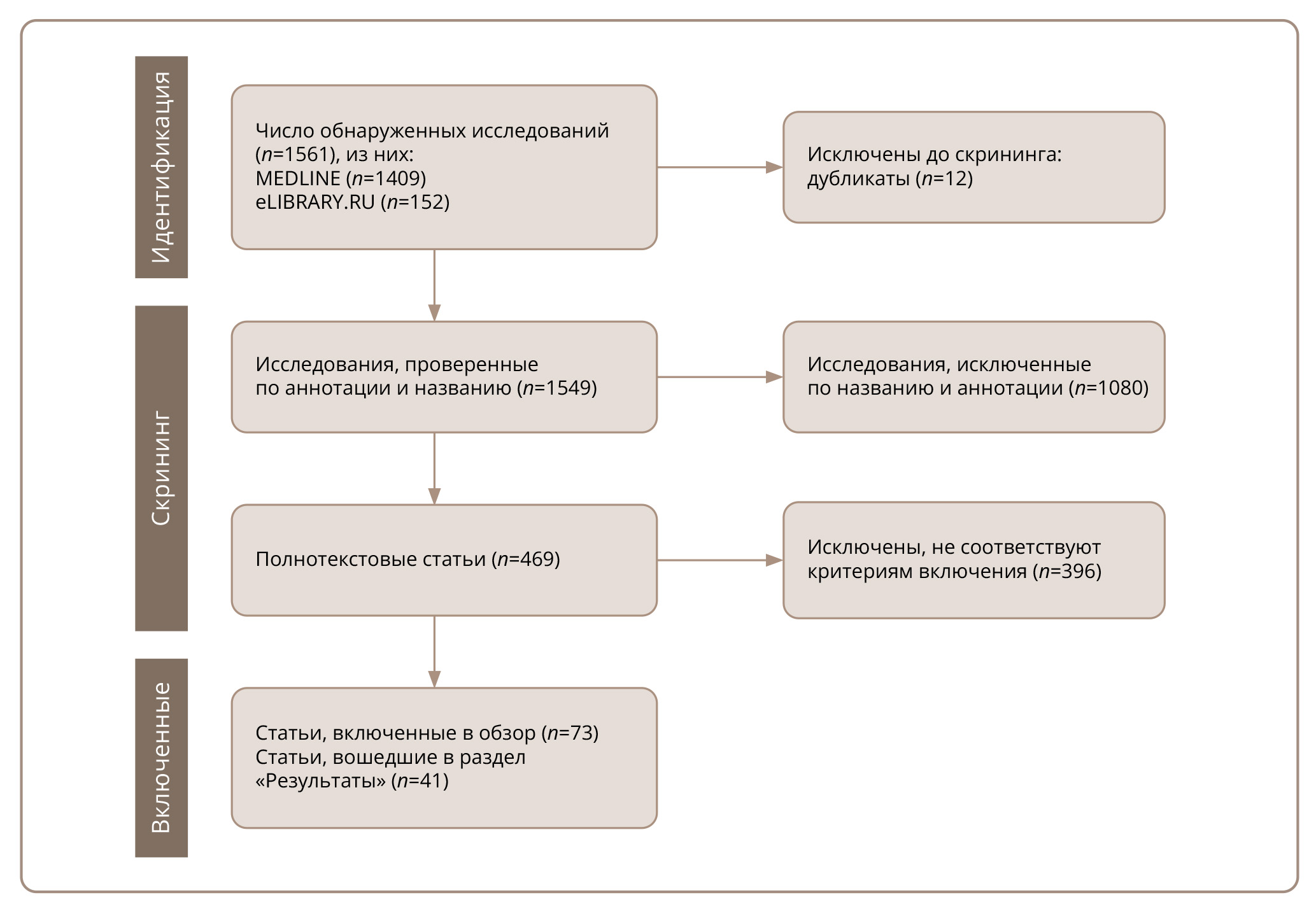
Рисунок 1. Методология поиска источников.
Источник: Крылов и соавт., 2025.
Процесс отбора
Каждая публикация была идентифицирована с помощью ручного поиска. Поиск и отбор публикаций проводили несколько специалистов из группы авторов данной статьи (см. раздел «Вклад авторов»). Некоторые публикации, отобранные на этапе скрининга, были исключены из дальнейшего анализа, поскольку не соответствовали критериям отбора (см. рис. 1).
Анализ результатов
Авторы проанализировали каждую публикацию и обобщили информацию из отобранных источников. Результаты обобщения представлены в структурированном тексте и рисунках.
РЕЗУЛЬТАТЫ
Ген SLC6A4 и его связь с психическими особенностями
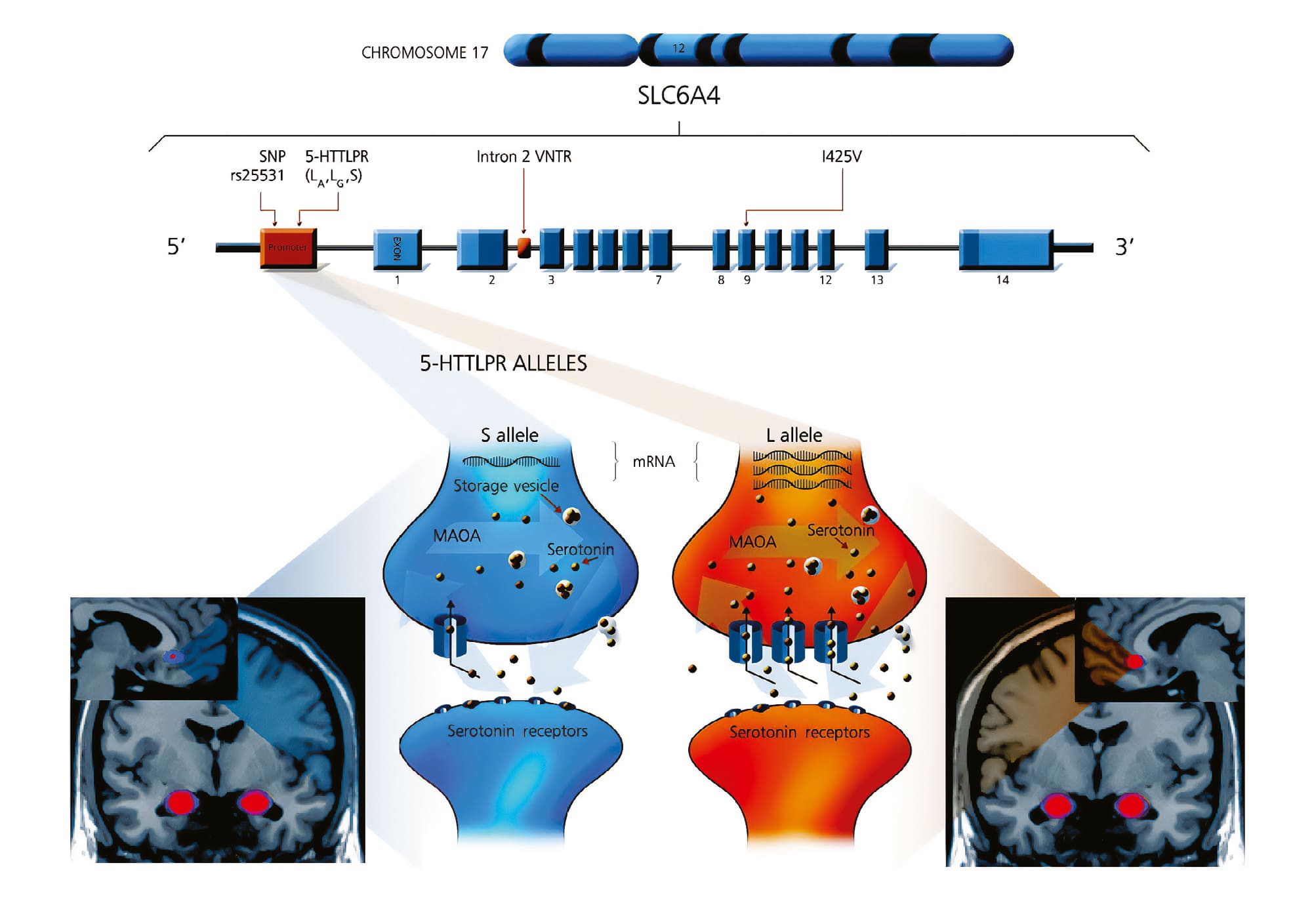
Полиморфный участок 5-HTTLPR (rs4795541) представляет собой функциональный инсерционно- делеционный полиморфизм 44 пар оснований в промоторной области гена-транспортера серотонина SLC6A4 (рис. 2) [21]. 5-HTTLPR — один из наиболее широко изученных вариантов в отношении психиатрических особенностей [22–24]. Он также широко исследовался в контексте промежуточных фенотипов, таких как нейровизуализационные модальности и взаимодействие генов и окружающей среды, причем последние обычно изучаются в связи с аффективными и тревожными фенотипами [21, 25, 26].
Примечание: 5-HTTLPR (serotonin transporter-linked polymorphic region) — полиморфный участок, связанный с транспортером серотонина; CHROMOSOME 17 — 17-я хромосома человека, содержащая ген SLC6A4; Intron 2 VNTR (variable number tandem repeat) — полиморфизм с варьирующим числом тандемных повторов во втором интроне гена SLC6A4; МАОА — моноаминоксидаза А; mRNA (messenger ribonucleic acid) — матричная рибонуклеиновая кислота; rs25531 — идентификатор однонуклеотидного полиморфизма (SNP) в гене SLC6A4, влияющий на экспрессию транспортера; SLC6A4 (solute carrier family 6 member 4) — ген, кодирующий белок-переносчик серотонина (серотониновый транспортер); SNP (Single Nucleotide Polymorphism) — однонуклеотидный полиморфизм.
Источник: Gerretsen и соавт., 2009 [21].
Однако следует отметить, что развитие аддиктивного расстройства — сложный процесс, который зависит от множества факторов, включая семейный анамнез, нейробиологию, социальное окружение и опыт [14]. И патологический аллель гена SLC6A4 является лишь одним из многих факторов, влияющих на эту психологическую характеристику [27].
В исследовании, сравнивающем частоту патогенных вариаций 5-HTTLPR и rs25531 A<G гена SLC6A4 среди якутов и других популяционных выборок, была выявлена высокая частота аллеля S, аналогичная наблюдаемой в популяциях китайцев и японцев [14, 25]. Согласно исследованию Nardi и соавт., аллель S (делеция) ассоциирован с более низкой экспрессией гена-транспортера серотонина [28]. Более того, носители S-аллеля демонстрируют повышенную чувствительность к раздражителям окружающей среды, что, вероятно, способствует накоплению этого аллеля у якутов [14].
Некоторые психические расстройства со сложным патогенным механизмом (например, шизофрения) связаны с нарушением серотониновой системы, что влияет на развитие и дифференцировку нейронов [29]. При этом ее транспортер, кодируемый геном SLC6A4, играет ключевую роль в регуляции уровня активности серотонинергической системы [30].
Сообщалось о связи между измененным метилированием ДНК гена, кодирующего транспортер серотонина SLC6A4, и расстройствами настроения, тревогой, а также чувствительностью миндалевидного тела [31]. Кроме того, некоторые исследования оценивали эпигенетические изменения в гене SLC6A4 у пациентов с шизофренией [32–34]. Известно, что сайты CpG (участки ДНК, состоящие из цитозина и гуанина, разделенных фосфатной группой) гена SLC6A4 демонстрируют изменения в уровнях метилирования у пациентов с биполярным расстройством [35]. Аналогичные результаты наблюдались и у пациентов мужского пола с шизофренией [36].
Влияние варианта 5-HTTLPR гена SLC6A4 на развитие аддикций
Научные исследования в области психогенетики за последнее десятилетие продемонстрировали, что значительная часть психических расстройств имеет генетическую природу [37]. Следует отметить, что злоупотребление алкоголем является основной причиной инвалидности и смертности среди людей [38]. Недостаточная осведомленность о вреде алкоголя и приверженность общества ритуалу веселья, при котором алкоголь является ключевым элементом объединения молодых людей, может привести к формированию поведенческих моделей потребления алкоголя [39].
Аддиктивные расстройства подразделяют на 2 типа:
- химические аддикции (алкоголизм, наркомания, токсикомания и т.д.);
- нехимические аддикции (патологический гэмблинг, компьютерная зависимость, интернет- зависимость и т.д.).
В совокупности они могут приводить к органическим нарушениям высших нервных функций, что в конечном итоге обусловливает развитие психических расстройств [40, 41]. Данные свидетельствуют о том, что может существовать дифференциальная генетическая уязвимость в серотонинергических генах для зависимости от алкоголя и опиатов [42]. Также имеются данные о том, что серотониновая система играет роль в патогенезе множества нейропсихических расстройств и может быть вовлечена в развитие такой зависимости, как курение, поскольку никотин увеличивает секрецию серотонина в головном мозге [43–45]. Предполагается, что никотин и другие компоненты табачного дыма могут содержать серотонин и тем самым способствовать развитию гомеостатической резистентности [46]. Исследователи отмечают, что генетические изменения у разных наций приводят к разным закономерностям. Например, среди жителей Техаса (США) с генотипом LL курение встречалось чаще, чем среди носителей аллеля S [47], тогда как вариант гена-транспортера серотонина 5-HTTLPR и его связь с курением среди населения Польши зарегистрированы не были [48].
Хорошо известно, что генетическая основа алкогольной зависимости заключается в механизме метаболизма этанола и последовательности цепочки вознаграждения (нейробиологическая система, связанная с выработкой дофамина и формированием зависимости) [49]. Заметно вырос интерес научного сообщества к ассоциации изменения области промотора гена-транспортера серотонина SLC6A4 c алкоголизмом [50]. Аллель S ассоциируется с употреблением алкоголя, а аллель L — с положительной фармакологической реакцией при разрешении абстинентного синдрома [51, 52].
Влияние варианта 5-HTTLPR гена SLC6A4 на результаты терапии антидепрессантами в различных этнических группах
СИОЗС (циталопрам, эсциталопрам, флуоксетин, флувоксамин) и серотониновые модуляторы с СИОЗС-подобными свойствами — основные фармакологические препараты для лечения больших депрессивных и тревожных расстройств [53–55]. В обновленных рекомендациях Консорциума по внедрению клинической фармакогенетики (Clinical Pharmacogenetics Implementation Consortium, CPIC) подчеркивается важность генотипирования генов CYP (CYP2D6, CYP2C19, CYP2B6) для оптимизации дозировки, вместе с тем наши знания о фармакодинамическом гене SLC6A4 остаются недостаточными для клинического применения [56, 57]. Антидепрессанты являются основным терапевтическим средством для пациентов с депрессией, однако примерно у 50% пациентов не достигается адекватного ответа на них [58]. Местом действия СИОЗС является переносчик серотонина, в связи с чем различные концентрации этого белка могут влиять на их эффективность как напрямую, так и через адаптивные изменения серотонинергической функции [59, 60]. Из-за различий в транскрипционной активности 5-HTTLPR доза СИОЗС может ингибировать большую долю серотонина у лиц, несущих аллель S, вызывая быстрое накопление синаптического серотонина и увеличивая риск развития нежелательных реакций [20]. Биаллельный (5-HTTLPR) и триаллельный (5-HTTLPR/rs25531) паттерны гена SLC6A4 исследуют часто, но их ассоциации с реакцией на антидепрессанты являются спорными [61]. Исследователи указывают на различия в ответе на лечение СИОЗС в зависимости от этнических вариаций 5-HTTLPR (S-аллель соотносится с лучшим ответом на антидепрессанты у корейцев и японцев, в то время как L-аллель связан с лучшим ответом у европейцев). При этом неясно, связаны ли 5-HTTLPR и его локус с высокой экспрессией rs25531 с ответом на антидепрессанты [62].
ОБСУЖДЕНИЕ
Краткая интерпретация результатов
Вариант 5-HTTLPR гена SLC6A4 может взаимодействовать с окружающей средой, влияя на формирование аддиктивных расстройств [59, 60]. Такие стрессовые события, как утраты или неблагоприятные бытовые условия, могут оказывать большее влияние на пациентов с аллелем S, делая их предрасположенными к аддиктивному поведению [63]. Также показано, что наличие S-аллеля может приводить к снижению концентрации серотонина в синапсах, что, в свою очередь, связано с повышенной предрасположенностью к развитию психических расстройств и аддиктивного поведения [63, 64]. На физиологическом уровне это может проявляться эмоциональной нестабильностью и повышенной чувствительностью к стрессу [15, 65]. Это подчеркивает важность учета как генетических, так и средовых факторов при оценке риска развития зависимостей [61, 66]. Как видно из табл. 1, распределение генотипов (LL, SL, SS) и аллелей (L/S) варианта 5-HTTLPR гена SLC6A4 значительно варьирует в разных этнических группах. Так, например, в азиатских популяциях (японцы, китайцы, якуты) преобладает (70,6–80,9%) S-аллель, а в европейских популяциях (русские, украинцы, белорусы) чаще (38,5–66,7%) встречается L-аллель [26]. Эти различия указывают на необходимость учета популяционной специфичности при интерпретации генетических рисков [26]. Фундаментальные исследования не выявили каких-либо уникальных нейробиологических маркеров (например, особенностей нейровизуализации или иммунных параметров), которые бы четко отличали носителей аллеля S от пациентов с другими генетическими профилями [20].
Таблица 1. Частоты генотипов и аллелей варианта 5-HTTLPR гена SLC6A4 в различных популяциях [26]
|
Популяция |
n |
Частота генотипов, % (n) |
Частота аллелей (%) |
Ссылка |
|||
|
LL |
SL |
SS |
L |
S |
|||
|
Русские (СПб.) |
908 |
38,10 (346) |
46,69 (424) |
15,19 (138) |
61,5 |
38,5 |
67 |
|
Украинцы |
60 |
21,21 (14) |
37,87 (25) |
40,90 (27) |
61,5 |
38,5 |
|
|
Белорусы |
39 |
46,15 (18) |
41,02 (16) |
12,82 (5) |
66,7 |
33,3 |
|
|
Чуваши |
372 |
24,46 (91) |
51,61 (192) |
23,92 (89) |
50,3 |
49,7 |
|
|
Кабардинцы |
289 |
26,64 (77) |
44,63 (129) |
28,71 (83) |
49,0 |
51,0 |
|
|
Татары |
142 |
26,05 (37) |
51,40 (73) |
22,53 (32) |
51,8 |
48,2 |
|
|
Якуты |
158 |
5,7 (9) |
32,3 (51) |
62,0 (98) |
21,8 |
78,2 |
26 |
|
Китайцы (Пекин) |
558 |
6,09 (34) |
36,02 (201) |
57,88 (323) |
24,1 |
75,9 |
44 |
|
Тайцы |
187 |
9,09 (17) |
36,89 (69) |
54,01 (101) |
27,5 |
72,5 |
20 |
|
Тайваньцы |
192 |
10,93 (21) |
36,97 (71) |
52,08 (100) |
29,4 |
70,6 |
68 |
|
Японцы |
101 |
3,7 (4) |
31,4 (31) |
65,7 (66) |
19,3 |
80,7 |
69 |
|
Японцы (Тоттори) |
501 |
3,19 (16) |
31,73 (159) |
65,06 (326) |
19,1 |
80,9 |
70 |
|
Китайцы (Шанхай) |
587 |
6,30 (37) |
41,39 (243) |
52,29 (307) |
27,0 |
73,0 |
71 |
Примечание: Указанные выборки (русские — СПб., японцы — Тоттори, китайцы — Шанхай, китайцы — Пекин) согласуются с данными оригинальных исследований (см. ссылки в таблице) и отражают локальные, а не общенациональные популяции. СПб. — Санкт-Петербург.
Обсуждение результатов
Недавно Bousman и соавт. в своем исследовании исключили ген SLC6A4 из клинических рекомендаций в связи с противоречивостью данных и недостаточностью доказательств для его клинического применения [56]. Однако Stein и соавт. в своем систематическом обзоре и метаанализе показали, что патологический вариант 5-HTTLPR может служить маркером результатов лечения антидепрессантами у пациентов с психическими расстройствами и может быть особенно релевантным при использовании СИОЗС у лиц европейского происхождения [68]. В своем исследовании Laje и соавт. [69] и Rahikainen и соавт. [70] установили, что мужчины с низкофункциональным генотипом S/S 5-HTTLPR/rs25531, принимающие СИОЗС (циталопрам), подвержены повышенному риску насильственного суицида (доведения до суицида). В то же время исследования, проведенные Jang и соавт. среди корейских пациентов с тяжелой депрессией, показали, что носительство генотипа S/S 5-HTTLPR было статистически значимо связано с лучшими результатами лечения, в то время как генотип, содержащий G (AG+GG) rs25531, ассоциировался только с ремиссией [71]. Несмотря на то что этот патологический аллель участвует в развитии аддиктивных расстройств, он не может служить клиническим маркером в силу отсутствия доказательной базы. Более того, на текущем этапе изучения многие исследователи связывают этот генетический вариант с другими психическими расстройствами, такими как депрессия и тревожность (табл. 2) [72, 73].
Таблица 2. Исследования вариации 5-HTTLPR гена SLC6A4
|
Категория |
Краткое описание |
Ссылка |
|
Исследования с участием людей |
||
|
Психические расстройства |
Связь с шизофренией, депрессией, тревогой в разных популяциях |
6, 14, 20, 27, 32, 33, 35, 37 |
|
Курение/никотин |
Ассоциация с никотиновой зависимостью и поведенческими паттернами |
10, 43, 44, 45, 46, 47 |
|
Алкоголь |
Роль 5-HTTLPR в алкогольной зависимости |
19, 51 |
|
Тревога/стресс |
Взаимосвязь с паническими атаками, стрессовой реактивностью |
17, 21, 22, 23, 61, 69, 70 |
|
Фармакогенетика |
Влияние на эффективность антидепрессантов (СИОЗС) |
53, 63, 67 |
|
Личность/нейродегенерация |
Роль в личностных чертах и нейродегенеративных процессах |
28, 29, 71 |
|
Популяционные различия |
Этническая вариативность аллелей и рисков |
25, 42 |
|
Эпигенетика |
Гиперметилирование промотора и его клинические корреляты |
30, 35, 36 |
|
Исследования на животных |
||
|
Эпигенетика/среда |
Влияние обогащения среды на экспрессию SLC6A4 и деметилирование у мышей |
34 |
Примечание: СИОЗС — селективные ингибиторы обратного захвата серотонина.
Ограничения обзора
Несмотря на то что охват научных публикаций по заданным в PubMed (MEDLINE) и eLIBRARY.RU ключевым словам позволяет предположить достаточную полноту обзора, описательный характер некоторых публикаций препятствовал их включению в работу. Ограничение поиска указанными поисковыми системами и ключевыми словами привело к неоднородности исследовательского материала в метаанализах, а также к ретроспективному характеру самих метаанализов и недостаточной полноте первоначально отобранных для них исследований. В рамках настоящего обзора были рассмотрены только 1 ген (SLC6A4) и 2 его варианта (5-HTTLPR и rs25531 A<G). Кроме того, плейотропные эффекты гена SLC6A4 связаны с депрессией и тревожностью, что ограничивает возможность изолированной интерпретации его роли в аддиктивных расстройствах. Авторы признают ограничения представленной информации и осознают, что работа даже при максимально возможном тщательном подходе не может охватить все аспекты рассматриваемой темы.
ЗАКЛЮЧЕНИЕ
В настоящем обзоре предпринята попытка систематизировать данные о роли варианта 5-HTTLPR гена SLC6A4 в развитии аддиктивных расстройств, подчеркнув его неоднозначность и плейотропные эффекты. В отличие от предыдущих исследований акцент сделан на необходимости многомерного подхода к оценке риска, учитывающего генетические, средовые и этнические факторы. Необходимы дальнейшие исследования с углубленным анализом молекулярных механизмов взаимодействия варианта 5-HTTLPR гена SLC6A4 с серотонинергической системой. Дальнейшие исследования также должны включать разработку персонализированных стратегий профилактики и лечения, которые потенциально могут повысить эффективность терапии зависимостей и снизить частоту развития нежелательных реакций.