Введение
В последние годы наблюдается стремительный рост распространения психозов, вызванных употреблением новых психоактивных веществ (НПВ) — синтетических соединений, имитирующих эффект классических наркотиков, но обладающих высокой токсичностью и непредсказуемым психогенным действием (Анцыборов, Мрыхин, 2017; Banister et al., 2016). Среди них особую угрозу представляют синтетические каннабиноиды и катиноны, способные вызывать острые психотические состояния даже при однократном приеме (Dargan, Albert, Wood, 2011; Every-Palmer, 2011).
Клиническая практика фиксирует всё большее число случаев шизофреноформных психозов, возникающих в контексте интоксикации НПВ, что значительно усложняет дифференциальную диагностику: врачу приходится различать эндогенное расстройство, спровоцированное экзогенным фактором, и острое экзогенное расстройство с шизофреноподобной симптоматикой (Дубатова и др., 2017; Менделевич, 2016). Схожесть продуктивной симптоматики (бред, галлюцинации, аффективные нарушения) указывает на необходимость поиска объективных диагностических критериев, в частности, нейрокогнитивного уровня анализа.
На фоне хорошо исследованной когнитивной дисфункции при шизофрении — в частности, нарушений исполнительных функций, внимания и памяти (Gold et al., 2012; Keefe et al., 2004), когнитивные особенности психозов, индуцированных НПВ, остаются недостаточно изученными. Существующие публикации в основном ограничиваются описанием клинических случаев или фрагментарными данными без единой концептуальной базы (Винникова, Шахова, 2016; Fattore, 2016).
Сравнение когнитивных особенностей при шизофрении и психозах, индуцированных новыми психоактивными веществами (НПВ), оправдано не только с теоретико-научной, но и с клинико-практической точки зрения. В условиях растущего распространения синтетических наркотиков, вызывающих острые психотические состояния с симптоматикой, схожей с шизофреническим спектром, главной задачей становится дифференциация происхождения психоза — экзогенного или эндогенного (Дубатова и др., 2017; Менделевич, 2016).
Обзор исследований
Память как высшая психическая функция представляет собой сложную систему, обеспечивающую непрерывность субъективного опыта, интеграцию прошлого с настоящим и формирование внутренней когнитивной картины мира. Она является одной из первых когнитивных функций, страдающих при психотических состояниях различного генеза, включая как эндогенные (шизофренические), так и экзогенные (интоксикационные) формы психозов (Плотников, Плотников, 2018; Keefe et al., 2004).
Для расстройств шизофренического спектра характерна устойчивая и клинически значимая дефицитарность памяти, охватывающая кратковременную, рабочую, эпизодическую и семантическую компоненты (Green, 1998; Heinrichs, Zakzanis, 1998; Weinberger, McClure, 2002). Нарушения памяти у данной категории пациентов оказывают выраженное влияние на повседневную деятельность, уровень социальной адаптации и стойкость ремиссий. По данным международных мета-анализов, уровень снижения когнитивной продуктивности в области памяти у больных шизофренией составляет от одного до полутора стандартных отклонений по сравнению с нормой (Gold et al., 2012; Nuechterlein et al., 2008).
Анализ когнитивных нарушений при расстройствах шизофренического спектра позволяет утверждать, что память выступает не изолированным элементом, а одним из компонентов более широкой нейрокогнитивной системы. Сетевая модель когнитивных дефицитов, предложенная М.В. Карякиной, показывает, что именно рабочая память и скорость обработки информации формируют центральные узлы когнитивного профиля при шизофрении (Карякина, Рычкова, Шмуклер, 2021). Показано также, что такие параметры, как темп обработки информации и вербальная беглость, имеют прогностическую значимость в отношении социальной адаптации пациентов (Алфимова, 2010). Это подчёркивает необходимость анализа когнитивных нарушений не как набора изолированных симптомов, а как сложных системных паттернов. При этом ключевую роль в идентификации глубинных сбоев когнитивной системы могут играть отдельные модули, в частности, как мы предполагаем, показатели памяти, снижение которых может рассматриваться как индикатор системной нейрокогнитивной дисфункции. С учётом данного аспекта память приобретает статус не только одного из когнитивных доменов, но и маркера более глубинных регуляторных нарушений. Анализ памяти в составе комплексных когнитивных паттернов представляется перспективным направлением, позволяющим выявлять скрытые нейропсихологические сдвиги в структуре психоза и уточнять их клиническую значимость.
Параллельно с этим исследования когнитивных нарушений у лиц, употребляющих синтетические психоактивные вещества, показали, что память также является одной из наиболее уязвимых когнитивных сфер. Одними из центральных проявлений интоксикационного психоза выступают стойкие нарушения именно памяти, как в острый период, так и в постинтоксикационной фазе (Бохан, Селиванов, 2015; Every-Palmer, 2011). Однако в имеющейся литературе зачастую преобладает обобщённый подход к описанию когнитивной дисфункции без выделения специфических паттернов нарушений памяти, что существенно ограничивает возможности дифференциальной диагностики. Однако прямое сопоставление когнитивного профиля при психозах экзогенного и эндогенного происхождения остаётся методологически ограниченным: существующие данные фрагментарны и несопоставимы по дизайну исследований (Фастовцов, Осколкова, 2018; Keefe et al., 2004). Этот дефицит сравнительных исследований препятствует выявлению специфических особенностей нейрокогнитивного дефицита при разных типах психозов.
Известно, что синтетические катиноны, такие как мефедрон, вызывают выраженные нейротоксические эффекты за счёт истощения пресинаптических моноаминовых резервов, особенно в дофаминергических и серотонинергических системах. Наиболее уязвимыми оказываются те нейронные сети, которые вовлечены в реализацию кратковременной и рабочей памяти (Анцыборов, Мрыхин, 2017; Zawilska, Wojcieszak, 2014). Это позволяет предположить наличие специфического дефицита в рабочей памяти и скорости обработки информации, аналогичного органическому когнитивному синдрому.
Синтетические каннабиноиды (например, JWH-018), напротив, оказывают влияние преимущественно на лимбические структуры, включая гиппокамп, что приводит к выраженным нарушениям консолидации слухоречевой информации, искажению воспоминаний и снижению продуктивности при повторном воспроизведении материала (Бохан, Селиванов, 2015; Vandrey et al., 2012). Данные эффекты моделируют нейропсихологический профиль латентного лобно-височного дефицита, что позволяет выдвинуть гипотезу о преимущественном поражении долговременной слухоречевой памяти.
Учитывая различия в патогенезе когнитивных нарушений при эндогенных и экзогенно обусловленных психозах, особую научную значимость приобретает сопоставление отдельных компонентов памяти, в частности операциональных, слухоречевых и регуляторных элементов, у пациентов с шизофренией и у лиц, перенёсших психоз, индуцированный НПВ. Для решения этой задачи существует множество нейропсихологических инструментов, в том числе не специфичных к определённой нозологии, а также батареи, разработанные для широкого патопсихологического обследования. Однако в условиях клинического исследования с участием пациентов в фазе постпсихотической стабилизации остро встаёт вопрос выбора чувствительной, валидированной и практически применимой методики, обеспечивающей стандартизированное сравнение двух неоднородных групп. В настоящем исследовании для оценки памяти использовалась русскоязычная версия Brief Assessment of Cognition in Schizophrenia (BACS) (Саркисян, Гурович, Киф, 2010; Keefe et al., 2004). Несмотря на то, что шкала была изначально создана для оценки когнитивного дефицита при шизофрении, её применение в данном контексте обусловлено рядом факторов.
Методика BACS адаптирована и нормирована для российской выборки, что позволяет проводить сопоставление между группами в пределах отечественного клинического пространства без необходимости экстраполяции зарубежных стандартов, но с возможностью сравнения с ними. Также субтесты BACS нацелены на оценку именно тех аспектов памяти, которые, согласно данным о нейротоксичности синтетических катинонов и каннабиноидов, подвержены наибольшему функциональному истощению — это, прежде всего, рабочая память и слухоречевая долговременная память (Анцыборов, Мрыхин, 2017; Бохан, Селиванов, 2015). Таким образом, методика обеспечивает возможность целенаправленного выявления предполагаемых различий без введения дополнительных инструментов. По данным ряда исследований, BACS демонстрирует кросс-диагностическую чувствительность — снижение показателей наблюдается не только при шизофрении, но и при иных психотических состояниях, включая острые экзогенные психозы (Колесников, Кондуфор, Рачкаускас, 2021), что делает её применимой и для оценки когнитивных последствий употребления НПВ. И наконец, BACS отличается оптимальной длительностью проведения (около 30 минут), что критически важно при работе с пациентами в подострой фазе расстройства: применение более протяжённых батарей, таких как CVLT-II или CANTAB, в условиях данного дизайна могло бы снизить надёжность данных вследствие утомляемости (Алфимова, 2010).
Исходя из поставленной проблематики, формируется основная гипотеза исследования:
Нарушения памяти при психотических состояниях, индуцированных новыми психоактивными веществами (НПВ), характеризуются иной структурой и степенью выраженности по сравнению с аналогичными нарушениями у пациентов с расстройствами шизофренического спектра, что может быть выявлено с помощью шкал батареи BACS.
Частные гипотезы исследования:
- У пациентов с расстройствами шизофренического спектра будет зафиксировано более выраженное снижение показателей рабочей памяти (шкала «Числовой ряд» BACS) по сравнению с пациентами, перенесшими интоксикационный психоз, вызванный употреблением НПВ.
- Пациенты, перенесшие психоз вследствие употребления синтетических каннабиноидов, продемонстрируют более выраженное снижение слухоречевой памяти (шкала «Заучивание слов») по сравнению с пациентами с шизофренией.
- Пациенты с НПВ-индуцированным психозом будут демонстрировать снижение скорости обработки информации при относительной сохранности первичного запоминания, в отличие от пациентов с шизофренией, у которых ожидается дефицит как в скорости, так и в точности кодирования.
Материалы и методы
Настоящее исследование представляет собой сравнительное поперечное квазиэкспериментальное исследование, направленное на изучение когнитивной дисфункции, связанной с нарушениями памяти, у пациентов с расстройствами шизофренического спектра и у лиц, перенёсших острый психоз, индуцированный новыми психоактивными веществами (НПВ).
Участники исследования
В исследование были включены 133 пациента мужского пола (после исключения двух человек с героиновой зависимостью), находившиеся на лечении в психиатрическом стационаре в условиях закрытого отделения. Все участники дали информированное согласие. Средний возраст выборки составил 31,26 года (SD = 7,57), варьируя от 19 до 44 лет.
Респонденты были распределены на две группы:
- Группа НПВ-психоза — 72 пациента, перенёсших острый психотический эпизод, ассоциированный с употреблением новых психоактивных веществ (синтетических катинонов или каннабиноидов). Психоз развивался остро, на фоне интоксикации указанных веществ, без предшествующего длительного анамнеза психического заболевания. Длительность выраженных психотических проявлений до госпитализации, как правило, не превышала нескольких дней (реже — 1–2 недели). В клинической картине у большинства наблюдался острый полиморфный психотический синдром с преобладанием галлюцинаторно-бредовой симптоматики (главным образом слуховые и зрительные галлюцинации, бред преследования, воздействия и др.), сопровождаемый выраженной аффективной нестабильностью, тревогой и психомоторным возбуждением. Течение расстройства носило краткосрочный острый характер: после устранения действия психоактивного вещества и начала терапии отмечалось относительно быстрое купирование психоза и обратное развитие симптоматики.
- Группа шизофрении (F20) — 61 пациент с подтвержденным диагнозом расстройства шизофренического спектра в соответствии с критериями МКБ-10. Длительность заболевания варьировала от нескольких месяцев до 10–15 лет, в среднем составляя порядка 7–8 лет от момента манифестации. Большинство больных имели параноидную форму шизофрении с эпизодическим течением (рецидивирующие психотические эпизоды с частичной ремиссией); причиной текущей госпитализации явилось обострение болезни. В остром периоде преобладала типичная для шизофрении галлюцинаторно-бредовая симптоматика (слуховые галлюцинации, бред преследования, воздействия и др.), иногда с кататоническими или аффективными включениями. К 5–6 дню после госпитализации на фоне терапии и уменьшения позитивной симптоматики у ряда пациентов проявлялись негативные расстройства (эмоциональное уплощение, снижение активности и др.).
Клинические диагнозы устанавливались на основании всестороннего психиатрического обследования (клинико-анамнестическое интервью с пациентом и родственниками, анализ медицинской документации) в соответствии с критериями МКБ-10. Диагноз психотического расстройства, индуцированного употреблением НПВ, в группе 1 кодировался по рубрикам F15.5 или F12.5 (в зависимости от преобладающего вещества — синтетического стимулятора или каннабиноида); в группе 2 подтверждался диагноз шизофрении (F20) с уточнением формы течения по клиническим данным. Для верификации диагноза и исключения первичного эндогенного расстройства у пациентов группы НПВ дополнительно использовалось структурированное клиническое интервью.
Все испытуемые обследованы на 5–6 день стационара, то есть после редукции острейших продуктивных симптомов и достижения частичной ремиссии. Критерии включения предусматривали возраст 18–50 лет, отсутствие тяжёлой соматоневрологической патологии и других первичных психических расстройств; к участию допускались лишь те пациенты, у которых в течение предшествующих 48 часов сохранялась стабильная поддерживающая доза антипсихотика без избыточной седативной нагрузки. Из выборки исключены лица с полинаркоманией или некупированным возбуждением. Отбор участников осуществлялся на основании сочетания чётко определённого клинического диагноза и состояния частичной или полной ремиссии, что позволяло исключить влияние выраженной психотической симптоматики на когнитивное тестирование Дополнительно из выборки исключались случаи полинаркомании: помимо упомянутых двух пациентов с опийной зависимостью, не включались лица с выраженной зависимостью от алкоголя или других ПАВ, не относящихся к синтетическим катинонам/каннабиноидам (во избежание влияния хронической интоксикации на когнитивные функции).
Все пациенты в период госпитализации получали стандартную медикаментозную терапию, направленную на купирование острого психоза, в соответствии с актуальными клиническими рекомендациями. Состав и режим назначения препаратов определялись тяжестью состояния и клиническими особенностями в каждой группе.
Методика
Для оценки состояния памяти использовалась русскоязычная адаптация шкалы BACS (Brief Assessment of Cognition in Schizophrenia) (Keefe et al., 2004; Саркисян и др., 2010), валидированная на отечественной выборке. Методика применялась в бумажной форме индивидуально в рамках патопсихологического обследования.
Анализу подвергались следующие показатели, отражающие различные аспекты памяти:
- Вербальная память (тест на заучивание 15 слов);
- Рабочая память (упорядочивание числовых рядов);
- Скорость обработки информации (кодировка символов).
Также дополнительно фиксировались данные по словесной беглости, двигательному тесту и тесту на проблемно-решающее поведение как маркеры регуляторных функций.
Статистическая обработка данных
Статистическая обработка эмпирического материала осуществлялась в несколько последовательных этапов с применением актуальных методов количественного анализа. Первоначально для оценки нормальности распределения каждой из переменных использовался тест Шапиро–Уилка. Это позволило определить соответствуют ли данные предпосылкам параметрических методов. В случаях, когда значения показателя p оказывались ниже уровня значимости 0,05, делался вывод о наличии статистически значимого отклонения от нормального распределения.
На следующем этапе применялся тест Левена для проверки гомогенности дисперсий между сравниваемыми группами. При установлении равенства дисперсий (p > 0,05) для дальнейшего анализа использовался параметрический t-тест Стьюдента. В случаях нарушения этого условия применялся t-тест Уэлча, адаптированный к условиям неоднородности дисперсий. Таким образом, выбор конкретного теста для сравнения средних значений зависел от результатов предварительных проверок.
Для переменных, которые не соответствовали параметрическим критериям (по нормальности или дисперсиям), применялся U-критерий Манна–Уитни как непараметрическая альтернатива t-тесту. Это позволяло получить достоверные результаты даже при нарушениях распределения данных.
Дополнительно рассчитывался коэффициент d Коэна, служащий показателем размера эффекта. Его значения позволяли интерпретировать силу различий между группами, при этом учитывались общепринятые ориентиры: d = 0,2 (малый эффект), d = 0,5 (средний), d = 0,8 и выше (крупный эффект). Также использовалась ранговая бисериальная корреляция для оценки степени связи между групповыми принадлежностями и распределением результатов по шкалам, особенно в условиях применения непараметрических методов.
Для всех основных показателей вычислялись 95% доверительные интервалы, что обеспечивало дополнительную надёжность интерпретации выявленных различий и позволило количественно оценить пределы вариативности между группами.
Обработка проводилась с использованием программ jamovi (версия 2.3) и R (версия 4.1) с подключением статистических пакетов car и ggstatsplot.
Результаты
Описательные статистики основных когнитивных показателей, связанных с памятью, представлены в таблице 1.
Таблица 1 / Table 1
Описательные статистики когнитивных показателей (стандартизированные значения)
Descriptive cognitive statistics (standardized values)
|
Шкала / Scale |
Группа / Group |
N |
Среднее / Mean |
Медиана / Median |
SD |
SE |
|
Числовой ряд / Number series |
НПВ / NPS |
71 |
–2,00 |
–2,01 |
1,28 |
0,152 |
|
Шизофрения / Schizophrenia |
62 |
–1,45 |
–1,11 |
1,62 |
0,205 |
|
|
Вербальная память / Verbal memory |
НПВ / NPS |
71 |
–1,59 |
–1,77 |
1,43 |
0,170 |
|
Шизофрения / Schizophrenia |
62 |
–2,07 |
–2,15 |
1,33 |
0,169 |
Note: NPS — new psychoactive substances.
Предварительный анализ распределения данных показал отклонения от нормального распределения по обеим шкалам (табл. 2), что подтверждено значимыми результатами теста Шапиро–Уилка. Проверка однородности дисперсий с использованием теста Левена не выявила значимых различий между группами, что позволило применять непараметрический анализ на основе сравнения рангов.
Таблица 2 / Table 2
Результаты проверки статистических предпосылок
Results of the verification of statistical assumptions
|
Шкала / Scale |
Тест / Test |
Значение / Value |
df₁ |
df₂ |
p |
Вывод / Conclusion |
|
Числовой ряд / Number series |
Шапиро–Уилк / Shapiro–Wilk |
W = 0,894 |
— |
— |
< 0,001 |
Распределение ненормальное / The distribution is abnormal |
|
Левен / Leven |
F = 1,660 |
1 |
131 |
0,200 |
Дисперсии однородны / The variances are homogeneous |
|
|
Вербальная память / Verbal memory |
Шапиро–Уилк / Shapiro–Wilk |
W = 0,948 |
— |
— |
< 0,001 |
Распределение ненормальное / The distribution is abnormal |
|
Левен / Leven |
F = 0,287 |
1 |
131 |
0,593 |
Дисперсии однородны / The variances are homogeneous |
Сравнительный анализ когнитивных показателей между группами проводился с использованием U-критерия Манна–Уитни. Результаты анализа представлены в таблице 3. Дополнительно рассчитывались значения коэффициента эффекта (d по Коэну) и ранговой бисериальной корреляции.
Таблица 3 / Table 3
Сравнение показателей памяти между группами (U-критерий Манна–Уитни)
Comparison of memory indicators between groups (U-criterion of Mann–Whitney)
|
Шкала / Scale |
U-Манна–Уитни / U-Mann–Whitney |
p (U) |
Разность рангов / Rank Difference |
d Коэна / Cohen’s d |
Ранговая корреляция / Rank correlation |
|
Числовой ряд / Number series |
1476 |
0,001 |
–0,718 |
–0,378 |
0,329 |
|
Вербальная память / Verbal memory |
1743 |
0,039 |
0,430 |
0,350 |
0,208 |
Рассмотрим результаты сравнения показателей подробнее.
По шкале «Числовой ряд» выявлены статистически значимые различия (U = 1476, p = 0,001): пациенты с НПВ-психозом продемонстрировали более выраженное снижение рабочей памяти. Размер эффекта составил d = –0,38, что соответствует среднему уровню (умеренная величина различий в 0.38 стандартного отклонения). Ранговая бисериальная корреляция составила r = 0,329, что также свидетельствует об умеренной связи между принадлежностью к группе и уровнем рабочего запоминания. Визуальное представление распределения представлено на рисунке 1.
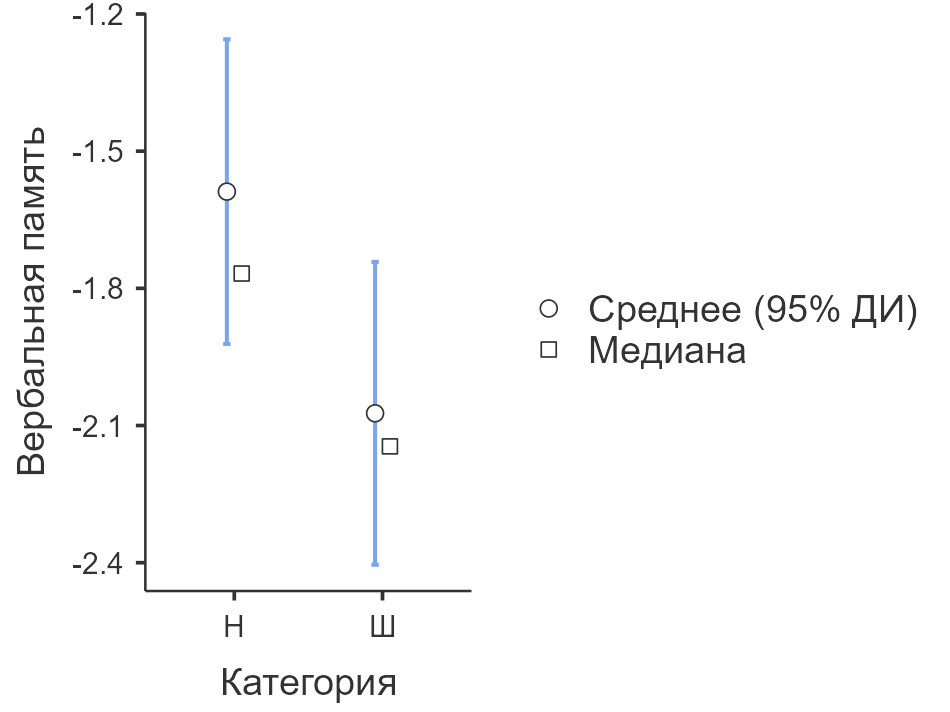
Рис. 1. Распределение стандартизированных значений по шкале «Числовой ряд» (рабочая память) у пациентов с НПВ-психозом и шизофренией (F20)
Fig. 1. Distribution of standardized values according to the scale «Number series» (working memory) in patients with NPS-psychosis and schizophrenia (F20)
По шкале «Вербальная память» также выявлены статистически значимые различия (U = 1743, p = 0,039): показатели слухоречевой памяти оказались ниже в группе пациентов с шизофренией. Значение d Коэна составило 0,35, что указывает на различие средней силы, а ранговая корреляция — r = 0,208, что интерпретируется как слабая, но значимая ассоциация между групповой принадлежностью и результатами по шкале. Визуальное представление распределения представлено на рисунке 2.
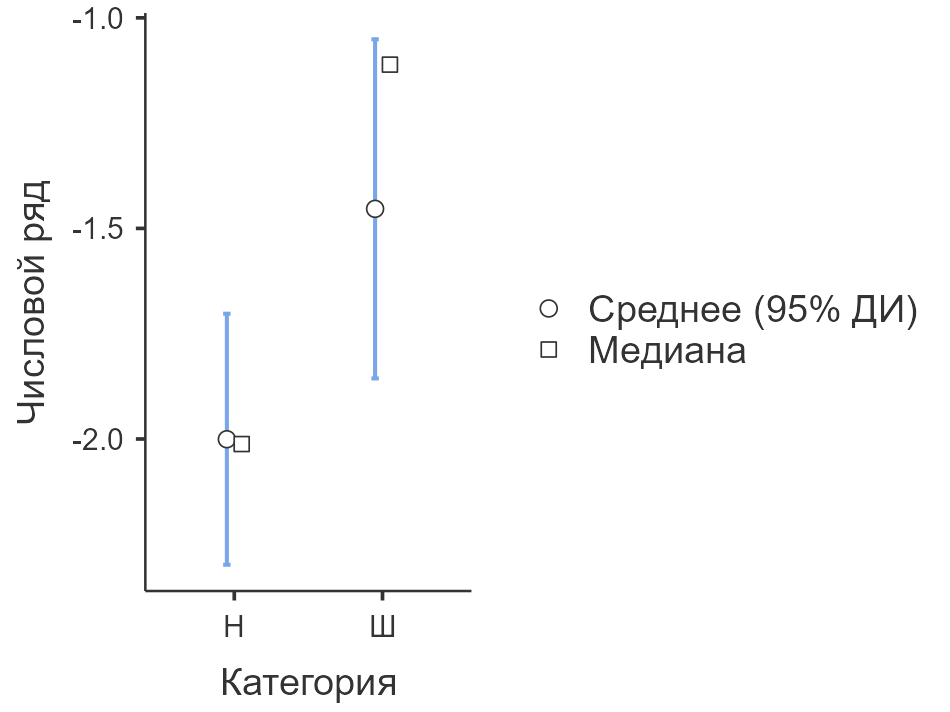
Рис. 2. Распределение стандартизированных значений по шкале «Вербальная память» у пациентов с НПВ-психозом и шизофренией (F20)
Fig. 2. Distribution of standardized values according to the scale «Verbal memory» in patients with NPS-psychosis and schizophrenia (F20)
Обсуждение результатов
В ходе настоящего исследования были установлены статистически значимые различия в характере нарушений памяти между двумя клиническими группами: пациентами с расстройствами шизофренического спектра и лицами, перенёсшими психоз, индуцированный употреблением новых психоактивных веществ (НПВ). Более выраженные дефициты рабочей памяти отмечены у пациентов с НПВ-психозом, в то время как наиболее выраженные нарушения слухоречевой памяти зафиксированы у пациентов с шизофренией.
Первая выдвинутая гипотеза — о более выраженном снижении рабочей памяти у пациентов с шизофренией — не получила эмпирического подтверждения и, соответственно, не может быть принята. Напротив, по шкале «Числовой ряд» (в составе BACS) участники с НПВ-психозом продемонстрировали более низкие результаты. Это может свидетельствовать о высокой степени функциональной и метаболической истощаемости систем рабочей памяти, возникающей под действием токсических веществ стимуляторного или полинаркотического спектра. Обнаруженный размер эффекта (Cohen’s d = –0,38) и умеренная сила связи с групповой принадлежностью (r = 0,329) позволяют интерпретировать результат как обладающий не только статистической значимостью, но и потенциальной клинической ценностью.
Вторая гипотеза — о снижении слухоречевой памяти у группы с НПВ-психозом — также не была подтверждена. Наоборот, по шкале «Вербальная память» пациенты с шизофренией показали более низкие результаты, что согласуется с известными представлениями о стойком дефиците процессов консолидации и хранения информации при эндогенных психозах. Размер эффекта (d = 0,35) и сравнительно низкая сила связи (r = 0,208) указывают на более выраженную межиндивидуальную вариативность в данной когнитивной области.
Таким образом, обе исследовательские гипотезы не были подтверждены, однако полученные результаты позволяют сформулировать новые направления анализа. В частности, различия в профиле когнитивного дефицита между группами могут отражать различную нейропсихологическую организацию нарушений при эндогенных и экзогенных психозах. У пациентов с НПВ-психозами выявляется преимущественно деструкция оперативных когнитивных систем (рабочая память), тогда как при шизофрении фиксируются нарушения процессов долговременной вербальной репрезентации. Эти наблюдения соответствуют различным сценариям когнитивной дезинтеграции — остро-индуцированной и хронически-эндогенной.
Тем не менее, интерпретация полученных данных требует определённой осторожности, учитывая ряд аспектов. В частности, в рамках настоящего этапа исследования не проводилась углублённая стратификация выборки по клиническим признакам. Включение более подробных характеристик выборки в будущих работах повысит точность интерпретации и воспроизводимость результатов.
Что касается используемого инструментария, применённая батарея BACS является широко апробированной и валидной в отношении оценки нейрокогнитивного дефицита у пациентов с шизофренией. Однако с учётом расширения исследуемой выборки за пределы эндогенных психозов, а также растущего интереса к феноменологии НПВ-индуцированных состояний, целесообразным представляется дальнейшее обогащение методического арсенала за счёт других нейропсихологических и психодиагностических подходов. Перспективным направлением может стать включение более широкого набора когнитивных доменов (внимание, исполнительные функции, когнитивная гибкость, зрительно-пространственная память), использование универсальных батарей (например, CANTAB, MoCA, ACE-R), а также внедрение клинико-психологических методик, зарекомендовавших себя в исследовании когнитивной патологии в условиях отечественной практики. Такой мультиинструментальный подход позволит не только уточнить структуру когнитивного дефицита в разных нозологических группах, но и повысит чувствительность анализа к паттернам, характерным для специфических подгрупп пациентов.
Следующая фаза исследования требует расширения когортной базы и многоцентровой репликации. Подобное решение представляется не только логичным, но и методологически необходимым. Согласно данным отечественных масштабных нейропсихологических проектов, устойчивые различия средней величины в ключевых когнитивных доменах, включая память, достигаются при численности выборки от 250 до 300 человек, равномерно распределённых по нескольким (двум и более) клиническим базам, обладающим разными диагностическими, терапевтическими и социально-культурными характеристиками (Карякина, Рычкова, Шмуклер, 2021). Многоцентровый формат обеспечит более высокую степень обобщаемости результатов, снизит влияние локальных организационно-медицинских различий и позволит оценить устойчивость выявленных паттернов когнитивных нарушений в разнородных клинических контекстах.
Не менее значимой задачей становится углублённая стратификация выборки, которая должна учитывать и представлять разнообразные биологические и социальные параметры пациентов (возраст, пол, уровень образования, семейное и социальное функционирование), так и клинические характеристики течения заболевания. В случае расстройств шизофренического спектра особенно важно разграничение стадий заболевания (первый психотический эпизод, подострое обострение, фаза ремиссии), поскольку накопленные данные свидетельствуют о различной степени выраженности и качественной структуре когнитивного дефицита на разных этапах расстройства (Карякина, Рычкова, Шмуклер, 2021). Это позволит не только проследить динамику когнитивных изменений, но и дифференцировать обратимые и стабильные компоненты нейропсихологического нарушения.
В отношении НПВ-индуцированных психозов принципиально важной представляется дополнительная стратификация по типу употребляемых веществ. Сопоставление пациентов, употреблявших преимущественно катиноны, каннабиноиды или полинаркотические комбинации, может позволить выявить специфические для разных веществ особенности когнитивного воздействия, включая токсическую нагрузку, степень возбуждающего эффекта, нейротоксичность и потенциальное влияние на определённые когнитивные домены. Такое разграничение крайне важно как для уточнения патогенеза, так и для разработки индивидуализированных программ восстановительного вмешательства.
Кроме того, в перспективе следует расширить диагностическую модель за счёт включения дополнительных психодиагностических методик, позволяющих более точно охарактеризовать эмоционально-личностные, мотивационные и регуляторные аспекты, сопутствующие когнитивному дефициту. Это могут быть как современные универсальные инструменты, так и отечественные методики, доказавшие свою клиническую ценность в исследовании когнитивной патологии (в том числе опросники, шкалы оценки психопатологических синдромов, комплексные нейропсихологические батареи). Подобное расширение обеспечит более глубокую и комплексную оценку профиля психического состояния пациента и его когнитивной сферы в целом.
Таким образом, переход от данного этапа к последующим исследованиям должен основываться на принципах увеличения выборки, клинической стратификации, многоуровневой оценки и междисциплинарного подхода, что позволит не только уточнить характер когнитивных нарушений при психозах различного генеза, но и расширит возможности для их практической интерпретации в рамках дифференциальной диагностики и персонализированной реабилитации.
Заключение
Настоящее исследование демонстрирует, что когнитивный профиль при психозах различного генеза подчиняется различным нейропсихологическим закономерностям. Обнаруженные различия в доминирующих типах нарушений памяти подтверждают необходимость отказа от универсальных когнитивных моделей и подчеркивают важность индивидуализированного подхода в клинической оценке и нейропсихологической интерпретации психотических состояний.
Полученные данные формируют обоснование для разработки дифференцированных диагностических стратегий и реабилитационных программ, адаптированных к особенностям как клинического течения, так и происхождения расстройства. В условиях растущей гетерогенности психотических расстройств, особенно в контексте распространённости НПВ, когнитивная оценка приобретает не только вспомогательное, но и потенциально ведущее значение в клиническом решении.
Дальнейшее развитие исследований в этом направлении потребует интеграции расширенного нейропсихологического инструментария, стратификации по клинико-демографическим и психопатологическим параметрам, а также внедрения продольных дизайнов. Такой подход обеспечит более точное понимание механизмов когнитивных нарушений и позволит перейти к построению персонализированных моделей когнитивного сопровождения в рамках современной психиатрической практики.
Ограничения. Среди ограничений настоящего исследования следует отметить ряд факторов, которые могут повлиять на интерпретацию полученных результатов. Во-первых, в исследовательский протокол не был включён контроль за характером, длительностью и дозировкой медикаментозной терапии, получаемой участниками в ходе госпитализации. Несмотря на то, что обследование проводилось на 5–6-й день после поступления, когда острые психотические симптомы были купированы, нельзя исключить остаточного влияния антипсихотических препаратов (в особенности седации) на показатели когнитивного тестирования. Отсутствие стандартизации схем лечения между группами также ограничивает возможность точной оценки степени лекарственного влияния.
Во-вторых, исследование носит поперечный (кросс-секционный) характер, что исключает возможность прослеживания когнитивных изменений во времени. Мы не можем с уверенностью утверждать, какие из нарушений носят стойкий, а какие — обратимый характер, особенно в группе с НПВ-психозами, где влияние острого интоксикационного компонента может ослабевать спустя недели или месяцы. Это существенно ограничивает прогностическую и клинико-диагностическую ценность данных.
Кроме того, состав выборки и условия проведения (одна клиническая база, ограниченный объём обследуемых, отсутствие женщин в выборке) затрудняют экстраполяцию результатов на более широкие клинические популяции. В исследовании не учитывались такие важные переменные, как уровень образования, premorbid IQ, социальное функционирование до манифестации расстройства, а также наличие или отсутствие сопутствующей аффективной симптоматики, что также может оказывать влияние на когнитивные показатели.
Limitations. This study has several limitations that need to be acknowledged when interpreting its findings. First, the study design did not include control over the type, dosage, or duration of pharmacological treatment received by participants during hospitalization. Although the cognitive assessment was conducted on days 5–6, after acute psychotic symptoms had subsided, residual effects from antipsychotic medication (particularly sedation) could still have affected performance. Furthermore, treatment regimens were not standardized across groups, which limits the ability to precisely estimate the impact of medication.
Second, the cross-sectional design of the study precludes the ability to observe the trajectory of cognitive changes over time. It is therefore not possible to determine whether impairments are permanent or reversible, especially in the NPS-induced psychosis group, where cognitive dysfunction might be partly attributable to acute toxic effects that dissipate over weeks or months.
Additionally, the study was conducted at a single clinical site, with a relatively small and homogeneous sample composed entirely of male patients. This limits the generalizability of the findings to broader clinical populations. Important variables such as educational attainment, premorbid IQ, pre-illness social functioning, and comorbid affective symptoms were not controlled for despite their potential influence on cognitive outcomes.