Введение
Нарушения процессов обработки зрительной информации при шизофрении известны давно. Эти нарушения значительно ухудшают повседневную деятельность людей, страдающих шизофренией, и их адаптацию к окружающей среде [29]. С ними связаны расстройства мышления и слуховые галлюцинации [45]. Существуют различные представления об их природе [12; 17; 30; 41; 52].
Нарушения обработки зрительной информации при шизофрении не до конца изучены. Известно, что при шизофрении могут наблюдаться множественные структурные и функциональные нарушения глаз и различных структур головного мозга. На сегодняшний день самым убедительным доказательством нарушений глаз при шизофрении являются расширение вен сетчатки, истончение слоя нервных волокон и аномальные амплитуды ЭРГ [Козуб, 2020; 9; 54]. С одной стороны, они могут быть связаны с болезнью, а с другой стороны — с приемом лекарственных средств или сопутствующими заболеваниями. Нарушения обработки зрительной информации хорошо известны при шизофрении, включая нарушения контрастной чувствительности [Козуб, 2020; 33; 36; 58], различных возбуждающих и тормозных функций [32; 48], обработки формы и движения [21; 30; 31; 53]. Несмотря на этот растущий объем доказательств, остается без ответа вопрос о том, в какой степени наблюдаемые проблемы обусловлены изменениями в головном мозге по сравнению с изменениями в структуре глаза. Уже было показано, что аномалии (т.е. гипо- или гиперактивация) существуют в затылочной [17], височной [51], теменной [24] и префронтальной [25; 50] областях во время выполнения различных когнитивных задач при шизофрении.
Эта работа посвящена анализу полученных данных для оценки роли головного мозга в нарушениях обработки зрительной информации при шизофрении. В качестве метода был выбран электрофизиологический метод классификации изображений.
В основе построения зрительной картины мира здорового человека находится классификация изображений различных объектов. Под термином «классификация» понимают процесс разделения наблюдаемых объектов на группы с разными свойствами в результате их распознавания. Деятельность человека в задачах классификации и распознавания изображений зависит от физических, семантических свойств изображений и от инструкции. Конечной целью анализа зрительной информации чаще всего является распределение наблюдаемых объектов по категориям, т.е. выделение семантической информации из изображения [4]. Этот многоуровневый процесс должен включать как предварительный анализ глобальной информации, общей формы объекта, так и характерные детали, и их взаимное расположение [11]. Часто механизмы локального и глобального анализа сцен и распознавания объектов связывают с работой двух систем — низкочастотной магно-системы и высокочастотной парво-системы. Магно-система чувствительна к высоким временным частотам и низким пространственным частотам, парво-система — к низким временным и высоким пространственным частотам. В фундаментальных исследованиях механизмов обработки зрительной информации и для объективизации и оценки временных характеристик процесса классификации и распознавания изображений активно применяют метод вызванных потенциалов с различными инструкциями наблюдателю [10; 18; 55; 59]. Актуальность исследования состоит в том, что комплексного исследования механизмов классификации, включая пространственно-частотные и семантические характеристики стимула с использованием инструкции наблюдателю с целью исследования осознанных и неосознанных процессов классификации у пациентов с психоневрологической патологией ранее не проводилось. Поэтому настоящее исследование является актуальным и позволяет внести определенный вклад в изучение особенностей нейрофизиологических механизмов классификации изображений в нейронных сетях головного мозга этих пациентов.
Использование комплексного метода позволяет более тонко оценить когнитивные нарушения пациентов относительно распространенного на данный момент в клинике спектрального анализа [14; 28]. Это обусловлено тем, что для метода когнитивных вызванных потенциалов выделено больше компонентов-маркеров при различных нарушениях, характерных для шизофрении [3; 15; 19; 20]. Для когнитивных вызванных потенциалов в качестве маркеров шизофрении выделены аномалии в амплитудах ряда компонентов: N100, P300, P500. Тогда, как спектральный анализ ограничивается только гамма-ритмом и оценкой 40 Гц-компонента. Кроме того, методы, нацеленные на спектральные аномалии, редко позволяют отличить один тип психических расстройств от другого. К достоинствам используемого нами метода стоит также отнести низкозатратность и простоту применения, в отличие от метода фМРТ. В последние годы исследователи, работающие с фМРТ стали активно применять обученные нейросети для диагностики шизофрении [20—22; 49]. Однако эти исследования требуют особой подготовки пациента, особых условий для проведения и являются дорогостоящими. В академических работах широко описываются, но еще не введены в широкое применение в клинике методы машинной диагностики [14; 15; 38; 43]. Эти методы обладают огромным потенциалом, однако сильно различаются в точности и не могут оценить особенности психического расстройства [15].
Современные теории сходятся во мнении, что основные аспекты патофизиологии шизофрении обусловлены дефицитом координации нейронной активности, которые затрагивают несколько областей коры головного мозга и характеризуют зрительную обработку среднего и более высокого уровня и когнитивные нарушения [17]. Известно, что искажение интеграционных процессов у этих пациентов связано с изменениями в восприятии пространственных и временных характеристик зрительных стимулов, обработка которых обеспечивается магно- и парво-системами [23; 26; 47]. Признаки нарушения этих систем на различных уровнях обработки зрительной информации при шизофрении демонстрируют психофизические, электрофизиологические исследования, а также оптическая когерентная томография [Козуб, 2020; 9; 14; 53].
Ранее в наших исследованиях по оценке функционального состояния магно- и парво-систембыли получены данные на группе здоровых наблюдателей [4; 7]. Было показано, что амплитуды компонентов когнитивных зрительных вызванных потенциалов при предъявлении изображений высокой пространственной частоты достоверно снижены по сравнению с низкой пространственной частотой на этапе первичного восприятия, а на более поздних этапах обработки зрительной информации амплитуды снижены при предъявлении изображений низкой пространственной частоты по сравнению с высокой. Поэтому для нашего исследования мы выбрали такой же метод. Предварительные данные, полученные на небольшой группе пациентов с шизофренией, были опубликованы ранее [7].
Цель настоящей работы — провести анализ электрофизиологических маркеров обработки зрительной информации при шизофрении с продолжительностью болезни от 1 года до 7 лет. Задачами исследования было проанализировать значения соотношения амплитуд ранних и поздних компонентов зрительных вызванных потенциалов, полученных с помощью метода классификации изображений.
Методы исследования
В исследовании на основе добровольного информированного согласия принимали участие 27 пациентов с параноидной формой шизофрении (F20 по МКБ — 10) — 15 мужчин и 12 женщин в возрасте от 20 до 35 лет с продолжительностью болезни от 1 до 7 лет без офтальмологической патологии и остротой зрения не менее 0,9. Все пациенты находились в стационаре и получали терапию атипичными антипсихотиками. Всем испытуемым были выполнены стандартный офтальмологический осмотр и электрофизиологическое исследование — измерение когнитивных зрительных вызванных потенциалов.
Среди симптомов, которые наблюдались у пациентов с шизофренией, участвовавших в исследовании, необходимо отметить эмоциональную однообразность, гипомимичность, напряженность и настороженность, тревожность. Были характерны также слуховые галлюцинации (голоса). Для пациентов было характерно доминирование продуктивных симптомов над негативными симптомами. Нарушения мышления и поведения не определяли клиническую картину обследованных пациентов. Со стороны работы головного мозга наблюдались нарушения структурирования мышления, снижение способности к концентрации внимания и сосредоточению.
Испытуемый располагался в затемненной комнате без посторонних раздражителей перед экраном монитора (17 дюймов) на расстоянии 1 м. Функциональные нарушения зрительной системы анализировались с помощью метода когнитивных зрительных вызванных потенциалов, описанного ранее [4; 6; 7]. Предъявлялись изображения объектов, подвергнутые цифровой фильтрации путем свертки изображений с DoG-функцией (сокр. от Difference of Gaussians), представляющей собой разность двух двумерных функций Гаусса с различной полушириной. Параметры фильтров были подобраны так, чтобы стимулы вызывали избирательную активацию двух систем зрения: высокочастотную парво-систему (с максимальным значением пропускания на частоте 10 цикл/град) и низкочастотную магно-систему (на частоте 1 цикл/град). Был использован набор из 90 монохромных контурных изображений в оттенках серого — половина изображений живой природы, половина — неживой природы (рис. 1). Средняя яркость и контраст всех изображений были одинаковы. Их предъявляли в случайном порядке на 100 мс с интервалом в 1 с. От пациента требовалось максимально быстро нажать на левую клавишу мышив половине измерений, когда он видит объект живой природы, и на правую клавишу в половине измерений, когда на экране — объект неживой природы. Регистрировались вероятность правильных ответов в процентах и количество опознанных значимых стимулов.
Рис. 1. Пример черно-белых изображений — объектов живой и неживой природы, подвергнутых цифровой фильтрации путем свёртки с DoG-функцией в области высоких (а) и низких пространственных частот (б)
Вызванные потенциалы регистрировались с помощью энцефалографа «Мицар-ЭЭГ-202» и программы WinEEG с помощью шапочки Electrocap с 19 электродами, расположенными на поверхности головы по системе 10—20 в отведениях Fp1; Fp2; F7; F3; Fz; F4; F8; T3; C3; Cz; C4; T4; T5; P3; Pz; P4; T6; O1; O2. Референтные электроды располагались на мочках ушей, а заземляющий электрод — в лобной области. Частота дискретизации составляла 250 Гц, полоса пропускания усилителей — 0,32—35 Гц.
Для обработки записи ЭЭГ использовался метод, описанный ранее [5; 6; 8]. Эпоха анализа продолжительностью в 700 мс была разделена на временные интервалы, соответствующие компонентам: N60; P100 (N100); N170 (P170); N200; N250 (P250); P300; P500. Для каждой области мозга выбирался более точный временной интервал; в каждом временном окне находили значения амплитуды, соответствующие пикам основных компонентов вызванного потенциала (максимум для позитивных волн и минимум для негативных волн) для каждого отведения (табл. 1). Наряду с электрофизиологическими данными регистрировались вероятность правильных ответов в процентах и количество опознанных значимых стимулов.
Таблица 1
Усредненные значения амплитуд компонентов вызванных потенциалов по отведениям для пациентов в зависимости от вида стимула (мкВ)
|
Отведение |
Компонент |
Границы периода |
ЖВЧ |
ЖНЧ |
НЖВЧ |
НЖНЧ |
|
Cz |
N100 |
136-156 |
-1,27 |
-1,05 |
-1,10 |
-0,52 |
|
P170 |
160-248 |
3,53 |
4,82 |
2,85 |
4,64 |
|
|
N250 |
252-320 |
-1,99 |
-0,96 |
-1,96 |
-2,82 |
|
|
P300 |
324-464 |
5,56 |
4,91 |
4,72 |
4,11 |
|
|
P500 |
468-696 |
8,06 |
7,92 |
8,07 |
7,11 |
|
|
T5 |
N60 |
72-100 |
-0,99 |
-1,19 |
-1,45 |
-0,40 |
|
P100 |
104-180 |
2,83 |
4,37 |
2,67 |
4,03 |
|
|
N200 |
184-220 |
-0,93 |
-0,71 |
-1,50 |
-0,19 |
|
|
P250 |
224-320 |
7,17 |
8,40 |
6,37 |
7,62 |
|
|
T6 |
N60 |
72-100 |
-1,25 |
-0,82 |
-1,22 |
-1,17 |
|
P100 |
104-180 |
3,25 |
3,29 |
2,79 |
3,84 |
|
|
N200 |
184-220 |
-1,37 |
-1,41 |
-1,22 |
-1,01 |
|
|
P250 |
224-320 |
6,94 |
7,96 |
5,63 |
6,71 |
|
|
Pz |
P170 |
216-332 |
7,80 |
8,50 |
6,53 |
7,52 |
|
N250 |
336-380 |
2,80 |
2,19 |
0,83 |
1,62 |
|
|
P300 |
384-428 |
6,54 |
5,66 |
4,82 |
4,44 |
|
|
P500 |
432-700 |
7,96 |
6,25 |
7,40 |
5,86 |
|
|
O1 |
N60 |
92-120 |
-1,56 |
-0,87 |
-2,05 |
-0,57 |
|
P100 |
120-180 |
2,37 |
5,20 |
1,77 |
5,79 |
|
|
N170 |
184-216 |
-1,92 |
-0,27 |
-2,35 |
0,38 |
|
|
P250 |
220-384 |
9,52 |
9,57 |
8,00 |
8,78 |
|
|
O2 |
N60 |
92-120 |
-1,58 |
-0,60 |
-1,90 |
-0,72 |
|
P100 |
120-180 |
3,11 |
5,54 |
2,15 |
6,65 |
|
|
N170 |
184-216 |
-1,84 |
0,54 |
-1,67 |
1,01 |
|
|
P250 |
220-384 |
10,66 |
11,35 |
9,88 |
10,07 |
Примечание: ЖВЧ — объекты живой природы высокой пространственной частоты; ЖНЧ — объекты живой природы низкой пространственной частоты; НЖВЧ — объекты неживой природы высокой пространственной частоты; НЖНЧ — объекты неживой природы низкой пространственной частоты.
Данные вызванных потенциалов были усреднены у всех пациентов, входящих в группу исследования. Статистический анализ данных проводился с использованием двухфакторного дисперсионного анализа для зависимых переменных ANOVA с зависимыми переменными — амплитудами вызванных потенциалов и факторами «частота» (высокие/низкие частоты) и «стимул» (объекты живой/неживой природы). Статистические решения принимались на 5% уровне значимости, данные представлены средними ± стандартными отклонениями Mean ± SD. Расчеты проводились с использованием программного комплекса в программе SPSS Inc 13 [Вершинина, 2019].
Результаты
В результате статистического анализа данных пациентов при оценке соотношения амплитуд компонентов вызванных потенциалов в зависимости от пространственно-частотных и семантических характеристик изображений были выявлены следующие достоверные изменения.
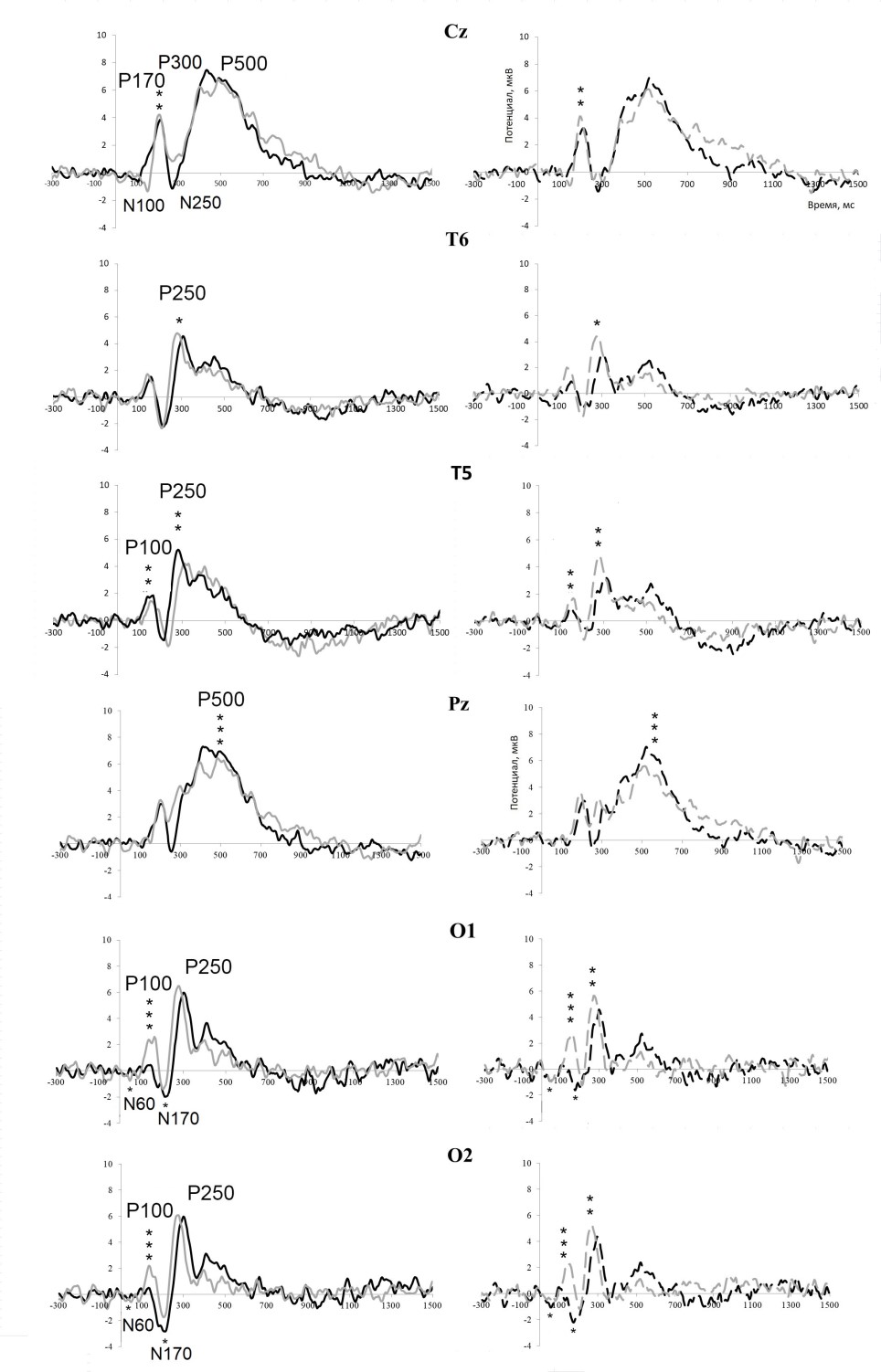
При предъявлении изображений, содержащих высокочастотную часть спектра, наблюдается достоверное снижение амплитуды компонентов по сравнению с ответом на изображения, содержащие низкочастотную часть спектра независимо от семантики стимула в определенных областях головного мозга (табл. 2). В затылочной области (в отведениях O1 и O2) было получено достоверное снижение амплитуды N60, P100 и N170, в затылочно-височной области слева (T5) — P100 и P250; в центральной области (Cz) — Р170; в центральной теменной области (Pz) — P500. В остальных зонах анализа достоверного различия между амплитудами в ответ на изображения высоких и низких пространственных частот получено не было. Достоверное различие амплитуд компонента P250 (N250) в зависимости от изменения семантики стимула отмечалось в затылочных (O1 и O2), задневисочных (Т5, Т6), центрально-теменном (Pz) и вертексном отведении (Cz). Усредненные вызванные потенциалы с обозначениями уровня статистической значимости представлены на рис. 2.
Таблица 2
Значимости главных эффектов p ANOVA, df1=1, df2=24 (p <0,05) по отведениям для компонентов вызванных потенциалов в зависимости от характеристики стимула: пространственной частоты (низкой и высокой)
|
Отведение |
Компонент |
Время |
Пространственная частота изображения (НЧ и ВЧ) |
|
O1 |
N |
60 |
НЧ > ВЧ: 0,020* |
|
O2 |
N |
60 |
НЧ > ВЧ: 0,030* |
|
T5 |
N |
60 |
0,184 |
|
T6 |
N |
60 |
0,384 |
|
Cz |
N |
100 |
0,333 |
|
O1 |
P |
100 |
НЧ> ВЧ: 0,000*** |
|
O2 |
P |
100 |
НЧ > ВЧ: 0,000*** |
|
T5 |
P |
100 |
НЧ > ВЧ: 0,003** |
|
T6 |
P |
100 |
0,181 |
|
Cz |
P |
170 |
НЧ > ВЧ: 0,005** |
|
O1 |
N |
170 |
НЧ > ВЧ: 0,017* |
|
O2 |
N |
170 |
НЧ > ВЧ: 0,003** |
|
Pz |
P |
170 |
0,059 |
|
T5 |
N |
200 |
0,184 |
|
T6 |
N |
200 |
0,862 |
|
Cz |
N |
250 |
0,916 |
|
O1 |
P |
250 |
0,395 |
|
O2 |
P |
250 |
0,386 |
|
Pz |
N |
250 |
0,828 |
|
T5 |
P |
250 |
НЧ > ВЧ: 0,002** |
|
T6 |
P |
250 |
НЧ > ВЧ:0,010* |
|
Cz |
P |
300 |
0,181 |
|
Pz |
P |
300 |
0,158 |
|
Cz |
P |
500 |
0,258 |
|
Pz |
P |
500 |
НЧ > ВЧ: 0,000*** |
Примечание: уровень значимости: «*» — p<0,05; «**» — p<0,01; «***» — p<0,001.
Статистический анализ при оценке соотношения амплитуд компонентов вызванных потенциалов в зависимости от семантических характеристик изображений показал следующие результаты. При предъявлении стимулов живой природы было получено достоверное снижение амплитуды компонентов по сравнению с ответом на изображения неживой природы в следующих отведениях (табл. 3). При предъявлении изображений низких пространственных частот было получено достоверное снижение амплитуды: в вертексном отведении (Cz) — N250, в правом затылочном (O2) и левом задневисочном отведении (T5) — P250. Достоверное различие амплитуд на стимулы высоких пространственных частот было получено: в правом затылочном отведении (O2) — P100, в центральном теменном отведении (Pz) — N250, в левом затылочном отведении (O1) — P250. Амплитуда всех вышеперечисленных компонентов в ответ на изображения неживой природы достоверно выше амплитуды в ответ на изображения живой природы. Достоверного отличия выявлено не было для следующих компонентов: в затылочных отведениях — N60, P100 (N100); в затылочном отведении слева (O1) — N170 (P170); в задневисочных отведениях — N200; в задневисочном отведении справа — N60, P100 (N100); в центральном теменном отведении (Pz) — P500; в вертексном отведении (Cz) — P100 (N100), N170 (P170), P300 и P500. Усредненные вызванные потенциалы пациентов с уровнями статистической значимости представлены на рис. 2.
Рис. 2. Усредненные вызванные потенциалы пациентов с шизофренией в центральном вертексном отведении (Сz), в затылочно-височном отведении слева (T5) и справа (Т6), в центральном теменном отведении (Pz) и в затылочных отведениях слева (O1, О2) на стимулы изображений объектов живой (А) и неживой (Б) природы, отфильтрованные по низким (серая линия) и по высоким (черная линия) пространственным частотам.
Звездочками показаны достоверные различия в зависимости от уровня значимости при сравнении соотношения амплитуд одного компонента внутри каждой семантической группы.
Уровень значимости: «*» — p <0,05; «**» — p <0,01; «***» — p <0,001
Таблица 3
Значимости главных эффектов p ANOVA, df1=1, df2=24 (p <0,05) по отведениям для компонентов вызванных потенциалов в зависимости от семантики стимула (живой и неживой природы) при низких и высоких пространственных частотах
|
Отведение |
Компонент |
Время |
ЖВЧ и НЖВЧ |
ЖНЧ и НЖНЧ |
|
Cz |
N |
100 |
- |
- |
|
Cz |
P |
170 |
- |
- |
|
Cz |
N |
250 |
- |
0,007** |
|
Cz |
P |
300 |
- |
- |
|
Cz |
P |
500 |
- |
- |
|
T5 |
N |
60 |
- |
0,018* |
|
T5 |
P |
100 |
- |
- |
|
T5 |
N |
200 |
- |
- |
|
T5 |
P |
250 |
- |
0,026* |
|
Pz |
P |
170 |
0,024* |
0,064 |
|
T6 |
N |
60 |
- |
- |
|
T6 |
P |
100 |
- |
- |
|
T6 |
N |
200 |
- |
- |
|
T6 |
P |
250 |
0,005** |
0,011* |
|
Pz |
N |
250 |
0,001** |
- |
|
Pz |
P |
300 |
0,018* |
0,021* |
|
Pz |
P |
500 |
- |
- |
|
O1 |
N |
60 |
- |
- |
|
O1 |
P |
100 |
- |
- |
|
O1 |
N |
170 |
- |
- |
|
O1 |
P |
250 |
0,003** |
- |
|
O2 |
N |
60 |
- |
- |
|
O2 |
P |
100 |
0,017* |
- |
|
O2 |
N |
170 |
- |
- |
|
O2 |
P |
250 |
- |
0,025* |
Примечание. ЖВЧ — объекты живой природы высокой пространственной частоты; НЖВЧ — объекты неживой природы высокой пространственной частоты; ЖНЧ — объекты живой природы низкой пространственной частоты; НЖНЧ — объекты неживой природы низкой пространственной частоты. Звездочками показаны достоверные различия в зависимости от уровня значимости при сравнении соотношения амплитуд одного компонента внутри каждой группы. Уровень значимости: «*» — p <0,05; «**» — p <0,01.
Таким образом, по полученным данным у пациентов с шизофренией в указанных областях при предъявлении изображений, отфильтрованных по высоким пространственным частотам, наблюдается достоверное снижение амплитуд для подавляющего большинства компонентов ЗВП независимо от семантики стимула и снижение амплитуды в ответ на изображения объектов живой природы по сравнению с неживой. При этом средняя вероятность правильных ответов у пациентов не менее 80%, что соответствует данным контрольной группы, описанным раннее [6].
Обсуждение результатов
Основные нейронные системы в зрительной системе человека представлены двумя параллельными каналами от сетчатки до затылочной коры, которые осуществляют анализ зрительной информации. Магно-система чувствительна к низким пространственным частотам, низким контрастам. Она обеспечивает «пространственное» зрение (локализацию объектов и ориентацию в пространстве). Парво-система чувствительна к высоким пространственным частотам, высоким контрастам. Она отвечает за «объектное зрение» (анализ цвета, текстуры и распознавание мелких деталей предметов и мелких объектов). Парво-система дает более медленный ответ по сравнению с магно-системой. В первичной зрительной коре начинаются вентральный (затылочно-височный) и дорсальный (затылочно-теменной) пути [23].
По полученным нами данным наблюдается достоверное снижение амплитуды ранних компонентов вызванных потенциалов — N60 и P100на стимулы высоких пространственных частот по сравнению с низкими пространственными частотами в затылочной и затылочно-височной области слева. Эти результаты соответствуют данным контрольной группы, полученным в ходе ранних исследований в нашей лаборатории с помощью этой же методики [4; 7]. В затылочных и затылочно-височных областях наблюдается снижение амплитуды компонентов, отвечающих за первичное восприятие (N60 и P100), в ответ на предъявление изображений высокой пространственной частоты по сравнению с низкой. Это связано с тем, что на этапе первичного восприятия происходит сначала анализ на низких, а затем на высоких пространственных частотах — сначала проводится глобальный, а затем детальный анализ объекта [5]. Таким образом, можно говорить о том, что у пациентов в затылочной области и затылочно-височной области соотношение амплитуд не меняется на этапе первичного восприятия по сравнению с данными контрольной группы.
В этой работе были получены также данные, свидетельствующие о том, что для более поздних компонентов ЗВП (N170 (P170); N200; N250 (P250); P300 и P500) характерно либо снижение амплитуды компонентов зрительных вызванных потенциалов, либо нет достоверного отличия в ответ на стимулы высокой пространственной частоты по сравнению с низкой. В наших ранних работах у контрольной группы было получено противоположное соотношение амплитуд вызванных потенциалов [7]. Эти компоненты отвечают за этапы первичной дифференцировки, сравнения с известными образами и первичного распознавания, за перевод в кратковременную рабочую память и принятие решения, за оперативную память. Данные, полученные ранее на группе здоровых субъектов, согласуются с результатами недавних исследований, проведенных с помощью магнитной энцефалографии и ФМРТ, которые показали, что и дорсальная, и вентральная области участвуют в обработке изображений как низкой, так и высокой пространственной частоты. В первичной зрительной области и вентральных областях (топографические регионы V1-V4, латеральные и вентральные затылочно-височные области, участвующие в визуальной обработке), а также в дорсальных областях (топографические регионы V3A, V3B, IPS01-IPS04, верхняя и нижняя области внутри теменной борозды) высокочастотные изображения вызывают более высокую амплитуду ответа, чем низкочастотные изображения [66]. Таким образом, полученные нами данные на пациентах свидетельствуют в пользу того, что у пациентов с шизофренией с продолжительностью болезни от 1 до 7 лет наблюдается доминирующее снижение активности высокочастотной парво-системы на поздних этапах обработки зрительной информации. Эта система, по данным исследований, у новорожденных формируется позже [57] и может быть развита благодаря дополнительному зрительному опыту [16].
Электрофизиологические результаты при шизофрении, свидетельствующие о нарушении активности нейронных сетей, противоречивы. Часть исследователей склоняются к тому, что при этой патологии наблюдается снижение активности преимущественно низкочастотной магно-системы [37; 41; 42; 56]. Другая часть исследователей пишут о нарушении активности высокочастотной парво-системы [13; 26; 44; 46] или двух систем одновременно [12]. Данные, полученные с помощью функциональной магнитно-резонансной томографии (ФМРТ) с использованием «низкочастотных» и «высокочастотных» зрительных стимулов у пациентов с шизофренией на ранних стадиях, свидетельствуют о снижении восприятия изображений только высоких пространственных частот (парво-система), а у хронических пациентов — о нарушении восприятия стимулов низких и высоких частот одновременно [13]. Это согласуется с полученными нами результатами.
Полученные нами электрофизиологические результаты совпадают с данными измерения контрастной чувствительности у пациентов с шизофренией, свидетельствующие о дисфункции парво-системы (парво-каналов) на начальных стадиях болезни, которые были опубликованы ранее [Козуб, 2020; 7; 9]. Было выявлено достоверное снижение средних значений пороговой контрастной чувствительности сетчатки в области высоких пространственных частот у пациентов с шизофренией. Измерение контрастной чувствительности, или визоконтрастометрия, является ведущим методом среди психофизических методов оценки восприятия изображений с различными пространственными частотами и применяется в клинике [6]. Величина контрастной чувствительности в значительной степени зависит от физических характеристик стимула, что, по мнению большинства ученых, подтверждает наличие в проводящей системе зрительного анализатора нескольких каналов, соответствующих определенным характеристикам этих стимулов.
Полученные нами результаты коррелируют с характерными клиническими проявлениями, которые наблюдались у исследуемой группы пациентов с шизофренией: быстрое цветовое утомление, резкое снижение функциональной устойчивости центрального хроматического зрения, а также незначительное снижение остроты зрения, неподдающееся коррекции с помощью оптических стекол. Эти симптомы характерны для нарушения работы высокочастотной парво-системы [5].
В процессе анализа данных пациентов по категориям объектов (объекты живой и неживой природы) нами были получены следующие результаты. Ответ на стимулы живой природы либо преобладает над стимулами неживой природы, либо нет достоверного различия. При низкой частоте изображения это характерно для ранних компонентов, а при высокой — для ранних и поздних компонентов зрительных вызванных потенциалов. Отсутствие различия амплитуд на поздних компонентах при различении объектов разных семантических категорий коррелирует с результатами исследований пациентов, страдающих шизофренией, методом зрительных вызванных потенциалов, направленным на оценку способности правильного объяснения значимых отношений между объектами или событиями (категоризации объектов) [40]. Также в работах других исследователей по категоризации при распознавании объектов живой и неживой природы при патологии психики обнаружены случаи избирательного ухудшения распознавания объектов живой природы при болезни Альцгеймера [27], аутизме, деменции [39] и шизофрении [35; 40]. Также было показано, что при травмах головного мозга с повреждениями лобно-височных областей гораздо чаще нарушается распознавание объектов живой природы [18]. Косвенным свидетельством важности для эволюционного развития зрительного восприятия объектов живой природы, например животных, является то, что они служат сигналами об опасности или об источнике пищи и требуют быстрого реагирования, а объекты неживой природы могут быть игнорированы [22; 34; 35; 41].
Таким образом, с помощью электрофизиологических исследований (метода когнитивных ЗВП) у пациентов, страдающих параноидной формой шизофрении с продолжительностью болезни от 1 года до 7 лет, мы выявили изменения, свидетельствующие о преимущественном снижении активности высокочастотной парво-системы (системы объектного зрения). Также для этой группы пациентов нами были получены данные, характерные для преимущественного нарушения распознавания объектов живой природы.
Условия проведения исследований соответствовали этическим нормам Хельсинкской декларации всемирной медицинской ассоциации. Все пациенты и здоровые наблюдатели подписывали информированное согласие.
Заключение
В работе был применен электрофизиологический метод классификации изображений с различными пространственными и семантическими характеристиками у пациентов с шизофренией продолжительностью болезни от 1 до 7 лет. Был проведен анализ электрофизиологических маркеров обработки зрительной информации при шизофрении. Получены данные в пользу нарушения обработки зрительной информации на поздних этапах. Таким образом, затронуты первичная дифференцировка, сравнение с известными образами и первичное распознавание, перевод в кратковременную рабочую память и принятие решения, перевод в оперативную память. Это свидетельствует в пользу дисфункции головного мозга на уровне глубокой обработки зрительной информации. Но для того, чтобы оценить вклад сетчатки в эти нарушения, необходим более глубокий анализ с помощью метода оптической когерентной ангиографии для исследования возможных сосудистых изменений сетчатки. Возможно, на более поздних стадиях развития шизофрении изменения со стороны сетчатки будут возрастать в связи с патологическим процессом или длительной лекарственной терапией. Однако на ранних этапах развития психоневрологической патологии описанный метод когнитивных зрительных вызванных потенциалов можно рекомендовать для использования в клинике для объективной оценки когнитивных нарушений и мониторинга терапии.