ВВЕДЕНИЕ
Шизофрения — тяжелое психическое расстройство, бремя которого растет во всем мире [1]. Назначение антипсихотической терапии является основным медицинским вмешательством при данном расстройстве [2]. Традиционно антипсихотики подразделяются на первое и второе поколения. Объединяющим признаком антипсихотиков первого поколения является прямая блокада D2-дофаминовых рецепторов [3]. Создание клозапина и попытки воспроизведения его уникального рецепторного профиля позволили выделить второе поколение антипсихотиков [4], для которых характерно значительное сродство к другим рецепторам, таким как серотониновым 5-HT2A, гистаминовым H1 и другим [4–6]. В последнее время из второго поколения стали выделять подгруппу антипсихотиков (третье поколение), главная особенность которых — парциальный агонизм к D2/D3 рецепторам [3, 4, 6]. На момент написания настоящей статьи этим свойством обладают арипипразол, брекспипразол и карипразин.
Выбор конкретного антипсихотика для лечения является многокомпонентной задачей, так как необходимо учитывать не только проявления заболевания и сопутствующую патологию, но и фармакологический профиль препаратов [7]. Существует большое количество препаратов, каждый из которых характеризуется своим профилем терапевтической активности и безопасности [5, 8]. Однозначная рекомендация по выбору конкретного наименования — клозапина — существует только для случая резистентной формы шизофрении [9]. В современных клинических рекомендациях также нет единства в выборе поколения антипсихотиков [5, 10]. В целом, отсутствуют четкие критерии выбора конкретного препарата для лечения шизофрении [11].
Тем не менее на практике врачи регулярно принимают решение о назначении конкретного препарата. Считается, что выбор врача обусловлен двумя основными критериями: вероятность того, что препарат будет эффективен в борьбе с заболеванием (эффективность) и вероятность того, что в результате применения не возникнут побочные эффекты (безопасность) [12–14]. Непосредственно на принятие решения влияют две системы: «система один» (интуитивная, автоматическая, основанная на опыте и аффекте) и «система два» (аналитическая, медленная, вербальная, логическая) [15, 16]. На сегодняшний день показана высокая роль бессознательного («система один») при принятии клинических решений [16]. Например, убежденность в эффективности и безопасности антипсихотиков второго поколения является более сильным аргументом при назначении препарата, нежели опровергающие ее данные [13]. На выбор поколения антипсихотика влияет стаж работы врача [17, 18], что косвенно подтверждает роль опыта при принятии решений. Таким образом, кроме эффективности и безопасности на принятие медицинских решений влияют разнообразные факторы, такие как, например, когнитивные искажения [19].
Несмотря на большое количество выполненных исследований, все еще существует необходимость в дальнейшем изучении процесса принятия решений. Нам не удалось найти ни одного исследования, в котором оценивались бы количественные различия в восприятии препаратов, и это стало причиной нашего решения провести настоящее исследование. Мы предполагали, что мнения психиатров не будут совпадать с эталонными различиями между препаратами, известными из метаанализов. Предпочтение, разумеется, будет отдано препарату с длительной историей применения, то есть рисперидону. Чтобы проверить эту гипотезу, были сформулированы статистические теории: а) структура ответов полностью совпадает со структурой исходных различий между препаратами; б) параметры количественной оценки восприятия и процесса принятия решений соответствуют исходным данным.
Отклонение этих статистических гипотез стало бы подтверждением наших исследовательских гипотез.
МЕТОДЫ
Формирование выборки
Объектом исследования являются субъективные оценки психиатров, работающих в государственной системе здравоохранения, относительно выбора антипсихотиков. Анкеты были распространены среди неограниченного числа психиатров. Требования к заполнению анкеты следующие:
1) наличие действующего документа, дающего право на оказание медицинской помощи в области психиатрии;
2) опыт применения карипразина для лечения шизофрении — более 5 пролеченных пациентов;
3) опыт применения рисперидона для лечения шизофрении — более 5 пролеченных пациентов.
Возврат заполненной анкеты являлся подтверждением согласия на участие в исследовании.
Отбор участников
Для набора участников в исследование применялась стратегия квотной выборки. В каждом государственном учреждении здравоохранения (3 психиатрических больницы, 2 психиатрических больницы с диспансером, 10 психоневрологических диспансеров) врачам-психиатрам предлагалась для заполнения анонимная анкета с вопросами. Место практической работы (амбулатория, дневной стационар, круглосуточный стационар) было квотной характеристикой. На каждую квоту предполагалось равное количество двух вариантов анкеты.
Поскольку анкетирование не требовало предоставления информации о пациенте, исследование было освобождено от этической экспертизы. Участникам была дана гарантия того, что будут предприняты все попытки обеспечить конфиденциальность ответов на вопросы анкеты. Административное принуждение исключалось при формировании выборки. Возвращение анонимной анкеты рассматривалось как свидетельство информированного согласия и добровольности участия в исследования. Подход к проведению исследования соответствовал этическим принципам, изложенным в Хельсинкской декларации.
Модель сравнения препаратов
Если свойства объектов могут быть описаны интервальными величинами, то разница по шкале измерения будет количественным показателем отличий. Однако этот вариант не подходит для случаев, когда инструменты измерения недоступны или связаны с оценочным суждением. Нарушение принципа эквидистантности приводит к несостоятельности прямого вычисления классических характеристик (суммарный балл, среднее арифметическое) и применения таких статистических моделей, как линейная регрессия, дисперсионный анализ и т. п. [20]. Для такого типа данных естественным выбором является порядковая регрессия [21]. Детали по рейтинговой модели изложены в Приложении А (в Дополнительных файлах).
В описанной методике используется классический сенсометрический протокол 2-альтернативного принудительного выбора с опцией «нет различий» (2-AC) [22]. Этот протокол обычно используется для определения предпочтения продукта. В данном конкретном исследовании мы стремились оценить восприятие психиатрами выраженности конкретного атрибута препарата, основываясь на их индивидуальном профессиональном опыте.
Переменные
Для сравнения были выбраны препараты рисперидон и карипразин. Рисперидон — старейший антипсихотик второго поколения [4]. В свое время эксперты расценивали его как препарат выбора для лечения шизофрении [23]. Рисперидон занимал лидирующие позиции в рейтинге назначений препаратов [13], и в месте проведения данного исследования — Санкт-Петербурге — ситуация была аналогичной [24]. Кроме узнаваемости и широкой известности рисперидона, на выбор повлияло его использование в качестве препарата сравнения в исследованиях карипразина [25–27].
Карипразин — новый препарат среди антипсихотиков. Это частичный агонист дофаминовых рецепторов D3/D2 с преимущественным воздействием на D3-рецепторы. В основе создания препарата лежало несколько предположений: сродство к D2-рецептором является обязательным, частичный агонизм или антагонизм к D3-рецепторам может улучшить когнитивные функции и снизить риск каталепсии, кроме того, препарат должен обладать большим сродством к D3-рецепторам [28]. Для карипразина показана эффективность в отношении основных симптомов шизофрении, в том числе при первом психотическом эпизоде, и хорошая переносимость [29–31]. Есть данные, свидетельствующие о высокой эффективности карипразина у пациентов с преобладающей негативной симптоматикой [25–27, 32].
Для построения модели сравнения препаратов использовались метаанализы M. Huhn и соавт. [8] и T. Pillinger и соавт. [33]. Исходными данными послужили результаты всех сетевых анализов: общее изменение симптомов, позитивные симптомы, негативные симптомы, депрессивные симптомы, все случаи прекращения участия в исследовании до его окончания, увеличение массы тела, использование антипаркинсонических средств, акатизия, увеличение уровня пролактина, удлинение интервала QT, седация, антихолинергические побочные эффекты [8], рост показателей общего холестерола, липопротеинов низкой плотности (ЛПНП), липопротеинов высокой плотности (ЛПВП), триглицеридов, глюкозы [33]. Использование поверхности под кривой кумулятивного ранжирования позволило выделить три позиции превосходства рисперидона, десять сопоставимых позиций и четыре позиции превосходства карипразина (3 – 10 – 4). Такое распределение результатов описывается теоретическими параметрами δ — 0,147 и τ — 1,167. Для обнаружения расчетных цифр потребовалось бы 928 ответов (мощность — 80%, доверительная вероятность — 95%).
Для снижения трудоемкости исследования рассматриваемые позиции были проанализированы на предмет их возможного исключения из анализа. Первой исключенной характеристикой стало общее изменение симптомов. Как правило, общий балл рассчитывается как сумма субшкал. Поскольку существует отдельная информация про негативные и позитивные симптомы, нет необходимости включения в анализ суммарного балла. Исключение прекращения участия в исследовании по любой причине связано с невозможностью оценки в клинической практике. Потребность в антипаркинсонической терапии не в полной мере отражала оценку возникновения паркинсонизма, поэтому была исключена. Исключение двух преимущественных характеристик для рисперидона и одной нейтральной характеристики привело к излишне оптимистичной разнице между препаратами (ряд 1 – 9 – 4, δ — 0,636, τ — 1,436, 54 наблюдения).
Также в эксперимент не включались показатели липопротеидов высокой, низкой плотности и триглицеридов по следующим причинам. Общий холестерол является композицией липопротеидов и обладает наилучшей стандартизацией при лабораторном исследовании по сравнению с другими липидами и липопротеидами [34]. Замена нескольких параметров одной общей переменной являлась способом упрощения модели. Кроме того, исключение лабораторного показателя ЛПНП, для которого показано преимущество карипразина, стало способом частично компенсировать исключение двух преимущественных характеристик рисперидона. Таким образом, для обнаружения разницы между ответами в последовательности «Рисперидон» — «Нет разницы» — «Карипразин» (1 – 7 – 3) потребовалось 79 наблюдений (δ — 0,517, τ — 1,372).
Кроме количественной разницы между препаратами (параметры δ и τ) возможно обнаружение качественных различий в восприятии. Количественная разница не отражает соответствие ответов исходному терапевтическому профилю препаратов. Поэтому качественная сторона восприятия оценивалась долей соответствия ответов респондентов исходно принятым преимуществам. В табл. 1 приведены исходные данные из приложений к метаанализам и принятые решения по каждому свойству препарата.
Таблица 1. Используемые характеристики карипразина и рисперидона в исследовании
|
Параметр |
Среднее значение [95% ДИ] |
Преимущество по результатам метаанализов |
|
«+» Позитивные симптомы (ССР) |
−0,30 [−0,46; −0,15] |
Рисперидон |
|
«+» Негативные симптомы (ССР) |
−0,04 [−0,17; 0,08] |
Нет разницы |
|
«+» Депрессивные симптомы (ССР) |
0,14 [−0,15; 0,43] |
Нет разницы |
|
«−» Увеличение массы (кг) |
0,71 [−0,09; 1,51] |
Нет разницы |
|
«−» Акатизия (ОР) |
Нет разницы |
|
|
«−» Подъем пролактина (нг/мл) |
Карипразин |
|
|
«−» Удлинение интервала QT (мс) |
Карипразин |
|
|
«−» Седация (ОР) |
Карипразин |
|
|
«−» Антихолинергические эффекты (ОР) |
Нет разницы |
|
|
«−» Холестерол (ССР) |
0,15 [−0,02; 0,31] |
Нет разницы |
|
«−» Глюкоза (ССР) |
−0,18 [−0,50; 0,14] |
Нет разницы |
Примечание: ССР — стандартизированная средняя разница, ОР — относительный риск, ДИ — доверительный интервал, «+» — преимущество оценивалось по большей относительности выраженности эффекта, «−» — преимущество оценивалось по меньшей относительной выраженности эффекта.
Вводная часть анкеты включала в себя вопросы, касающиеся стажа работы, места работы (амбулаторная служба, дневной стационар, круглосуточный стационар), назначения препаратов и количества пролеченных пациентов. Первый вопрос основной части касался непосредственного выбора между карипразином и рисперидоном в максимально неопределенных обстоятельствах. Во втором вопросе респондента просили попарно сравнить три фактора, которые наиболее важны при назначении лекарств: доступность и наличие льготного лекарственного обеспечения, эффективность препарата и профиль побочных эффектов. Поскольку эти два вопроса являются предметом отдельного анализа, в данной работе они не используются. Для противодействия эффекту последовательности все анкеты были разделены на два варианта. В вопросах 1 и 3 первого варианта список ответов начинался с карипразина, а второго — с рисперидона. В вопросе 2 последовательность пар сравнения была зеркальной в каждом из вариантов. Данный подход соответствует требованиям, предъявляемым к протоколу 2-AC [35]. В Приложении Б приведен пример анкеты, которая предлагалась для заполнения.
Статистический анализ
Для описания категориальных переменных использовались абсолютные значения и доли от целого — n (%). Переменные, имеющие непрерывный характер распределения, описывались средним (М). При необходимости приводились 95%-ные доверительные интервалы для вычисляемых параметров (lwr; upr). Также вычислялись минимальное и максимальное значение (|min; max|).
Плановое количество респондентов рассчитывалось при помощи функции twoACpwr, а параметры дискриминации — функцией twoAC1. Для учета повторных измерений количество необходимых ответов приравнивалось к количеству требуемых анкет. Описание протокола 2-AC и его технической реализации дано в публикации разработчика библиотеки sensR [22]. Соответствие паттерна ответов результатам метаанализа выполнялось при помощи библиотеки opa2, предназначенной для проверки соответствия наблюдаемой структуры ответов гипотетическому распределению [36]. Производились расчеты процента корректной классификации (PCC) и коэффициента случайности результата (c-value). Для определения относительной разницы в ответах [37] использовалось вычисление мультиномиального распределения с 95%-ным доверительным интервалом функцией MultinomCI3 . Ассоциация между переменными оценивалась порядковой регрессией4. Сила ассоциации между переменными представлялась в виде отношения шансов и 95%-ного доверительного интервала (odds [lwr; upr]). Все расчеты производились на языке программирования Rv4.2.35.
РЕЗУЛЬТАТЫ
Всего опросили 79 врачей-психиатров. Средний стаж работы по специальности составил 11,0 (9,4, 12,7) лет, наименьший — 2 года, наибольший — 40 лет. Продолжительность использования карипразина варьировалась от 5 до 48 месяцев, рисперидона — от 11 до 264 месяцев. Субъективная оценка количества пролеченных пациентов карипразином равна 10,5 (8,6, 12,5), рисперидоном — 360,1 (95,3, 624,9). Распределение врачей в зависимости от их рабочего места было следующим: амбулатория — 34,1%, дневной стационар — 32,9%, круглосуточный стационар — 32,9%.
В табл. 2 приведено распределение ответов на вопросы по восприятию клинической разницы между препаратами. При анализе соответствия паттерна ответов респондентов гипотетической модели установлено, что только 44,37% (c <0,001) соответствовали гипотезе.
Таблица 2. Распределение ответов на вопросы восприятия разницы препаратов.
|
Параметр |
Рисперидон (доля, [95% ДИ]) |
Нет разницы (доля, [95% ДИ]) |
Карипразин (доля, [95% ДИ]) |
Преимущество по результатам метаанализа |
Преимущество по результатам опроса |
|
«+» Позитивные симптомы |
0,57 (0,43; 0,72), n=45 |
0,42 (0,28; 0,57), n=33 |
0,01 (0,00; 0,17), n=1 |
Рисперидон |
Рисперидон |
|
«+» Негативные симптомы |
0,01 (0,00; 0,06), n=1 |
0,05 (0,00; 0,10), n=4 |
0,94 (0,89; 0,99), n=74 |
Нет разницы |
Карипразин |
|
«+» Депрессивные симптомы |
0,04 (0,00; 0,16), n=3 |
0,24 (0,13; 0,36), n=19 |
0,72 (0,61; 0,84), n=57 |
Нет разницы |
Карипразин |
|
«−» Акатизия |
0,32 (0,16; 0,48), n=25 |
0,42 (0,27; 0,58), n=33 |
0,27 (0,11; 0,43), n=21 |
Нет разницы |
Нет разницы |
|
«−» Антихолинергические симптомы |
0,03 (0,00; 0,16), n=2 |
0,70 (0,58; 0,83), n=55 |
0,28 (0,16; 0,41), n=22 |
Нет разницы |
Нет разницы |
|
«−» Седация |
0,00 (0,00; 0,11), n=0 |
0,23 (0,13; 0,34), n=18 |
0,77 (0,67; 0,88), n=61 |
Карипразин |
Карипразин |
|
«−» Набор массы |
0,01 (0,00; 0,11), n=1 |
0,16 (0,08; 0,26), n=13 |
0,82 (0,73; 0,92), n=65 |
Нет разницы |
Карипразин |
|
«−» Удлинение интервала QT |
0,00 (0,00; 0,09), n=0 |
0,86 (0,78; 0,95), n=68 |
0,14 (0,06; 0,23), n=11 |
Карипразин |
Нет разницы |
|
«−» Увеличение пролактина |
0,00 (0,00; 0,11), n=0 |
0,23 (0,13; 0,34), n=18 |
0,77 (0,67; 0,88), n=61 |
Карипразин |
Карипразин |
|
«−» Увеличение глюкозы |
0,01 (0,00; 0,13), n=1 |
0,76 (0,66; 0,88), n=60 |
0,23 (0,13; 0,35), n=18 |
Нет разницы |
Нет разницы |
|
«−» Увеличение холестерола |
0,00 (0,00; 0,10), n=0 |
0,82 (0,73; 0,92), n=65 |
0,18 (0,09; 0,28), n=14 |
Нет разницы |
Нет разницы |
Примечание: n — количество наблюдений, ДИ — доверительный интервал, «+» — преимущество оценивалось по большей относительной выраженности эффекта, «−» — преимущество оценивалось по меньшей относительной выраженности эффекта.
При анализе профиля ответов было обнаружено, что большинство респондентов считают рисперидон (0,57 (0,43; 0,72)) более эффективным с точки зрения устранения позитивных симптомов. Однако это не отличалось от доли тех, кто сообщил о сопоставимом антипсихотическом эффекте между препаратами (0,42 (0,28; 0,57)). Преимущество карипразина в подавляющем большинстве случаев наблюдалось в отношении его влияния на негативные (0,94 (0,89; 0,99)) и депрессивные (0,72 (0,61; 0,84)) симптомы. Карипразин также был оценен как более безопасный, чем рисперидон, в отношении риска следующих побочных эффектов: седативный эффект (0,77 (0,67; 0,88)), увеличение веса (0,82 (0,73; 0,92)) и повышение уровня пролактина (0,77 (0,67; 0,88)). Риск антихолинергических побочных эффектов (0,70 (0,58; 0,83)), удлинения интервала QT (0,86 (0,78; 0,95)), повышения уровня глюкозы (0,76 (0,66; 0,88)) и холестеринемии (0,82 (0,73; 0,92)) был оценен как сопоставимый между препаратами. Большинство респондентов оценили риск развития акатизии как сопоставимый (0,42 (0,27; 0,58)), но это мало чем отличалось от доли тех, кто считал карипразин более безопасным (0,27 (0,11; 0,43)).
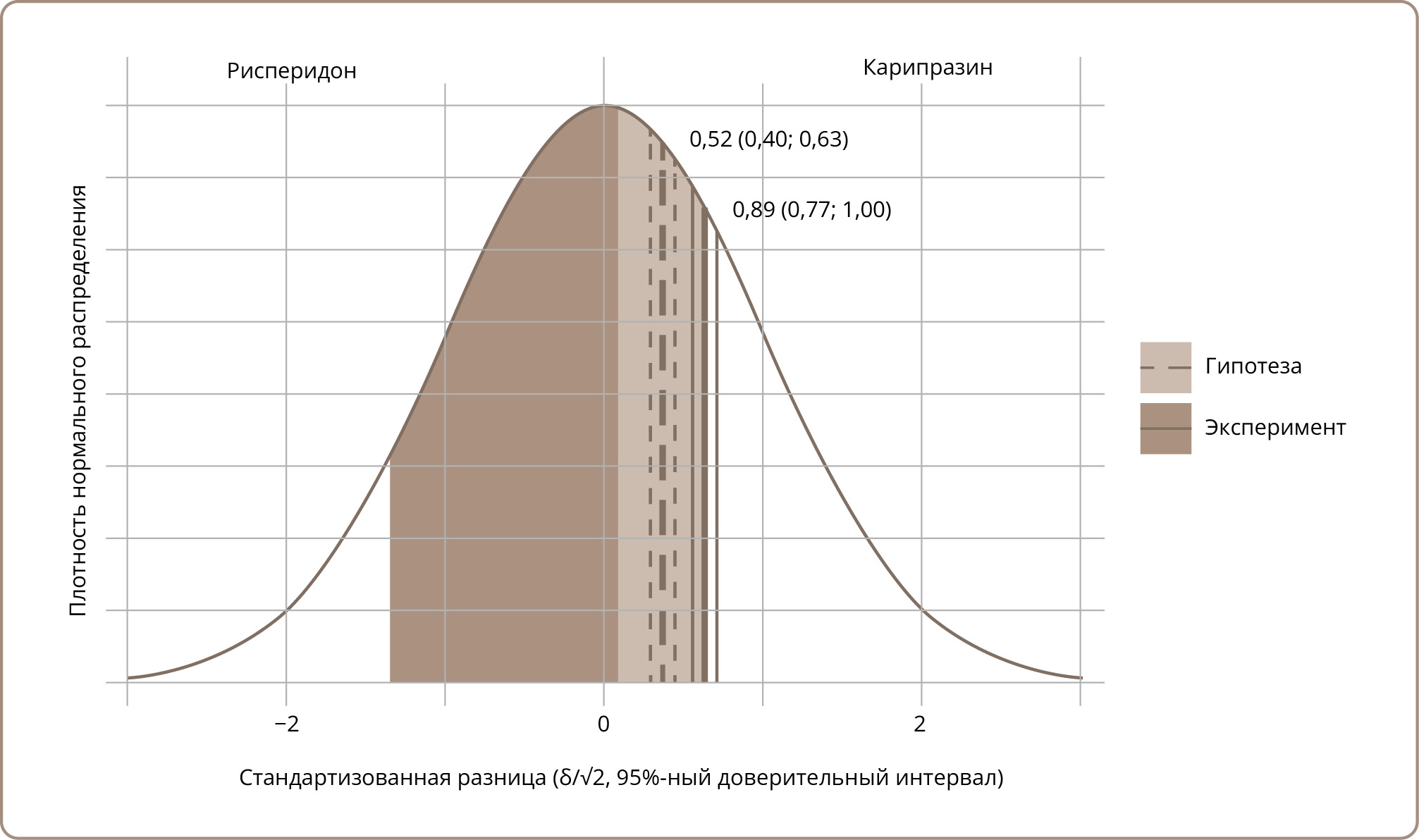
При расчете параметров восприятия были получены следующие результаты: δ — 0,889 (0,774, 1,004), τ — 1,001. Полученный индекс дискриминации больше расчетного, их доверительные интервалы не пересекаются (приорное значение — 0,517 (0,404, 0,630)). Граница категории «Нет разницы» меньше расчетной (приорное τ — 1,372). Результаты указывают на статистически значимую разницу между гипотезой и эмпирическими данными. На рис. 1 приведены индексы дискриминации гипотезы и полученного результата.
Рисунок 1. Стандартизированное распределение разницы между препаратами.
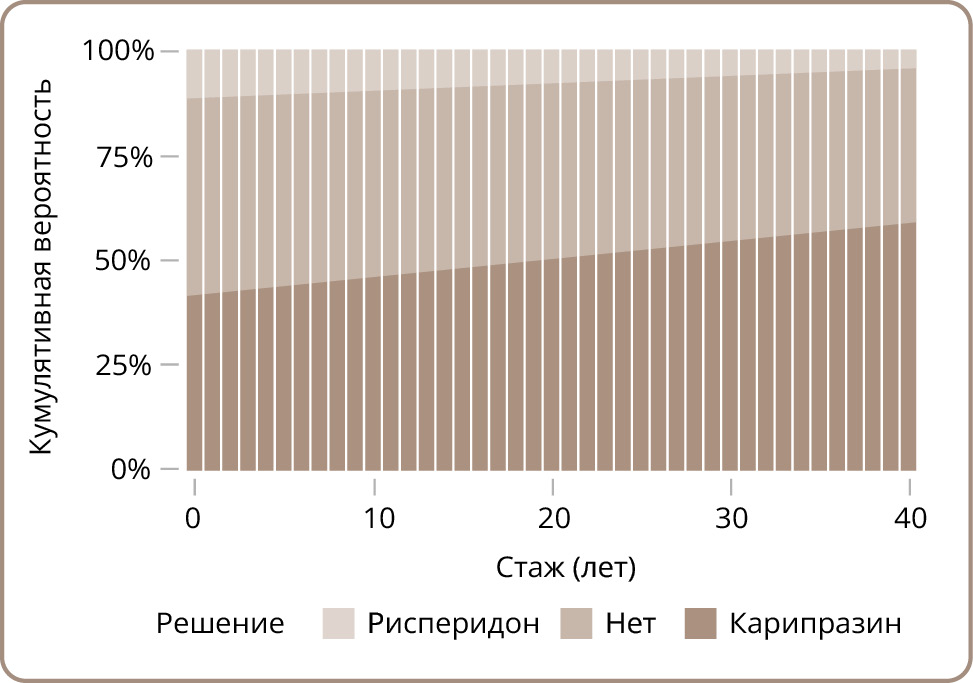
Кроме того, была выполнена проверка гипотезы влияния стажа работы на восприятие разницы в препаратах. Добавление возраста в качестве ковариаты улучшило характеристики модели (AIC 1622,97 против 1624,94). Параметр стажа работы преодолел классический порог статистической значимости (0,01 [0, 00; 0, 02], p=0,047). Также произошла коррекция параметра δ в сторону небольшого уменьшения (0,725). На рис. 2 отражена взаимосвязь стажа работы и вероятности применения карипразина: при увеличении стажа работы эта вероятность растет, тогда как доля ответов «Нет разницы» и «Рисперидон» снижается. Ассоциации между соответствием индивидуального паттерна ответов гипотетической модели и стажем работы обнаружено не было (p=0,870).
Рисунок 2. Вероятность ответа в зависимости от стажа работы.
ОБСУЖДЕНИЕ
Целью этого исследования была оценка количественных различий в восприятии психиатрами эффективности и безопасности различных антипсихотических препаратов. Применение протокола 2-AC позволило количественно оценить разницу в восприятии препаратов и сравнить ее с эталонной разницей. В качестве эталона были взяты данные метаанализов, по результатам которых были высчитаны базовые значения параметров дискриминации и принятия решения: δ — 0,517, τ — 1,372. По данным анкетирования параметры имели следующие значения: δ — 0,889, τ — 1,001. Также оценивалась качественная сторона восприятия. Полное совпадение структуры ответов данным метаанализов эквивалентно 100% PCC. Наблюдаемое значение 44,37% указывает на несоответствие структуры восприятия врачей-психиатров объективным данным. Таким образом, первая часть гипотезы исследования была подтверждена. Что касается смещения восприятия в пользу рисперидона, то гипотеза не подтвердилась.
Ежедневно врачи принимают решения, последствия которых влияют на жизнь пациентов и общества в целом [38]. Даже в условиях значительной неопределенности врач способен прогнозировать последствия и находить решения. Цена такой способности — когнитивные искажения и ошибки, которые могут негативно повлиять на конечный результат [19]. По этой причине необходимо внедрение систем поддержки принятия решений, задача которых — минимизация количества ошибочных решений [12]. Функционирование таких систем зависит от заложенной разработчиками информации и алгоритмов. Например, легко реализовать систему выбора препарата при лечении делирия с удлинением интервала QT [39]. Значительно сложнее объективизировать рейтинг антипсихотиков [40].
Создание индекса персонального выбора антипсихотика [40] было одной из попыток составить подобный рейтинг на основе профилей терапевтической активности в исследованиях препаратов методом экспертных оценок. Составление подобного рейтинга на основе численных характеристик возможно на базе крупных метаанализов [8, 33]. Однако данные исследования не учитывают восприятие терапевтической эффективности как врачей, так и пациентов. Известно, что пациенты предпочли бы препараты, меньше всего вызывающие чувство усталости и проблемы с памятью [41]. Также была показана разница подходов к выбору препаратов врачами и пациентами [42], что, на наш взгляд, связано с восприятием собственно проблемы заболевания и путей борьбы с ним.
Восприятие терапевтических свойств препаратов является частным случаем этой общей проблемы. И от исходной информации зависят как предположения, так и принимаемые решения. Это продемонстрировано на примере выполненного исследования. Авторы метаанализа [8] намеренно исключили исследования, посвященные терапевтическому эффекту препаратов у пациентов с преобладающими или заметными негативными симптомами, так как это предмет отдельного исследования [43]. По этой причине в исходной гипотезе предполагалось отсутствие различий между рисперидоном и карипразином по эффективности воздействия на негативную симптоматику. Однако в восприятии врачей очевидна существенная разница между карипразином и рисперидоном в отношении воздействия на негативную симптоматику, так как в практике нет специфического разделения пациентов на подгруппы.
С депрессивной симптоматикой, вероятно, ситуация похожая. Ожидаемая разница между карипразином и рисперидоном по воздействию на симптомы депрессии была невелика (0,14 (−0,15; 0,43)) [8], хотя на практике она воспринимается как сильная. Полученный результат может быть объяснен тем, что общая оценка складывается из множества факторов. Например, негативные симптомы и симптомы депрессии разделить затруднительно [44, 45]; поэтому нельзя исключить, что отраженный в опыте врачей антидепрессивный эффект мог быть связан с изменением выраженности негативной симптоматики. Следует отметить, что исходные данные касаются только депрессивных симптомов в структуре психотического эпизода, тогда как депрессия при шизофрении является более сложным явлением [46].
Это также может объяснить разницу в оценке интервала QT и наборе массы тела, а не реальных клинических эффектов. Известно, что на карипразине по сравнению с плацебо отмечена тенденция к сокращению интервала QT на −1,45 (−6,20; 3,20) мс, тогда как на рисперидоне доказан эффект увеличения интервала на 4,77 (2,68; 6,87) мс [8]. Однако эти результаты указывают на статистическую разницу, которая может не совпадать с практической значимостью [52]. На наш взгляд, если врачи не замечали критических осложнений при терапии препаратами, то они могли не обратить внимание и на разницу между карипразином и рисперидоном, несмотря на сравнительную безопасность карипразина по этому параметру. Тем не менее, схожая структура различий по критерию набора массы воспринимается иначе. На карипразине среднее увеличение массы тела составило менее одного килограмма (0,73 (−0,06; 1,52)), что сопоставимо с плацебо. На рисперидоне зафиксировано увеличение массы тела более чем на килограмм (1,44 (1,05; 1,83)). Казалось бы, вывод должен быть такой же, как при оценке сердечной деятельности, но набор массы тела беспокоит пациентов [41, 42], и они, скорее всего, обращают внимание на эту проблему в своих жалобах. С другой стороны, врачи также обеспокоены риском увеличения массы тела у пациентов [42]. Это может послужить объяснением того, почему статистически незначимая разница между карипразином и рисперидоном (0,71, (−0,09; 1,51) кг) воспринимается как преимущество карипразина.
Наконец, необходимы пояснения по поводу ассоциации стажа работы с индексом дискриминации. Мы ожидали, что бо́льший стаж работы врача должен был связан с увеличением количества ответов «рисперидон» по параметрам, которые не являются преимущественными для рисперидона. Гипотеза основывалась на предпочтении антипсихотиков первого поколения врачами с бо́льшим стажем работы [17, 18]. По аналогии, более «старый» препарат — рисперидон, воспринимался бы более предпочтительным, однако гипотеза не подтвердилась. На наш взгляд, оценка эффективности и безопасности не равна принятию решения по выбору препарата. Необходимы дальнейшие исследования с целью выявления причин и механизмов влияния стажа работы на восприятие разницы между препаратами.
Ограничения
Во-первых, исследование ограничивалось субъективным выбором исходных параметров для создания модели. Модель базировалась на результатах двух сетевых метаанализов и не включала в себя все терапевтические свойства препаратов. Кроме того, при упрощении исследовательской модели не удалось равномерно исключить преимущества для препаратов. Поэтому набор тестируемых параметров нельзя признать идеально сбалансированным. Во-вторых, местом проведения. Все врачи-респонденты являлись сотрудниками государственных учреждений Санкт-Петербурга. Мы полагаем, что в других городах и регионах России результат может отличаться от полученного. В-третьих, результаты проведенного исследования нельзя рассматривать как руководство к тому или иному действию в клинической практике. В-четвертых, по результатам нельзя судить о терапевтических свойствах препаратов, так как целью исследования была оценка восприятия врачей-психиатров, а не оценка лекарственных препаратов в клинической практике.
ЗАКЛЮЧЕНИЕ
Насколько нам известно, текущее исследование является первым, в котором параметризуются характеристики безопасности и эффективности с использованием сенсометрической теории. Впервые была выявлена количественная разница в восприятии терапевтических свойств нейролептиков на примерах карипразина и рисперидона. Клиницисты обычно воспринимают различия между лекарственными средствами, и эти различия более резкие, чем ожидалось. Характер воспринимаемых различий не полностью согласуется с результатами клинических испытаний. Этот результат может быть учтен при обновлении клинических рекомендаций и дальнейшей разработке систем поддержки принятия решений.
1 Christensen R, Brockhoff P (2023). sensR: Thurstonian Models for Sensory Discrimination. R package version 1.5−3. Available online: https://CRAN.R-project.org/package=sensR.
2 Beechey T. (2023). Opa: An implementation of ordinal pattern analysis. Available online: https://CRAN.R-project.org/package=opa.
3 Signorell A. (2023) DescTools: Tools for Descriptive Statistics. R package version 0.99.48.; 2023. Available online: https://CRAN.R-project.org/package=DescTools.
4 Christensen RHB. (2023). Ordinal - Regression Models for Ordinal Data. R package version 2022.11−16.; 2022. Available online: https://CRAN.R-project.org/package=ordinal.
5 R Core Team (2023). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. Available online: https://www.R-project.org/.