Введение
Под пикацизмом понимается постоянное употребление непищевых продуктов, которое может представлять угрозу для жизни. Недавнее исследование, проведенное при поддержке Центров по контролю за заболеваниями (CDC), показало, что 23,2% людей с аутизмом демонстрируют пикацизм. При этом пикацизм наблюдается у 4,5% детей с нарушениями развития, отличными от расстройств аутистического спектра (РАС), и у 3,6% детей из контрольной группы нейротипичных детей [Fields]. В исследовании взрослых с аутизмом процент идентифицированных с коморбидным паттерном пикацизма достигает 60% [Kinnell, 1985].
В публикациях результатов исследований по проблемам пикацизма и аутизма рассматривается симптоматика заболеваний желудочно-кишечного тракта как последствия этих расстройств. Проблемы с желудочно-кишечным трактом, часто встречающиеся при аутизме, включают запор, диарею, ГЭРБ (гастроэзофагиальную рефлюксную болезнь), вздутие живота, повышенное газообразование, боль в животе, рвоту и тошноту [Edelson, 2019; Holingue, 2018; Toguleva, 2018]. Кроме того, Хорват [Horvath, 1999] обнаружил, что около 70% аутичных детей страдают эзофагитом и дуоденитом.
Пикацизм уже давно связывают с гастритом / Helicobacter pylori (H. pylori) [Sayar, 1975], колитом [DiCagno, 1974] и целиакией [Korman, 1990]. Другие исследователи сообщают, что пикацизм приводит к перфорации и закупорке кишечника, паразитам, хирургическим вмешательствам для удаления предметов из желудка, отравлению свинцом и к смерти людей с интеллектуальными нарушениями, а также и нейротипичных [Ausman, 1974; Danford, 1982а; Greenberg, 1958]. Что касается людей с интеллектуальными проблемами, Матсон [Matson, 2011] охарактеризовал пикацизм как наиболее опасный тип самоповреждающего поведения, а также наименее изученный из всех типов аберрантного поведения.
Исследования, проведенные Сюй с коллегами, показали, что «у пациентов с РАС наблюдались изменения микробиоты кишечника. Эти изменения потенциально имели отношение к поведенческим и желудочно-кишечным симптомам, которые коррелировали с тяжестью РАС, сделано предположение, что ось кишечник – мозг участвует в патогенезе РАС» [Xu, 2019, с. 6, 7]. Кражмальник-Браун с коллегами [Krajmalnik-Brown, 2015] сообщили об отсутствии разнообразия в штаммах бактерий, в то время как метаанализ Сюй выявил процент и относительную численность видов бактерий, как вредных, так и полезных, у детей с РАС и из контрольной группы. Кан и ее коллеги постулировали, что вредные бактерии могут выделять опасные разрушительные метаболиты, которые могут влиять на кишечник, тело и мозг. Терапия переноса микробиоты привела к значительному улучшению симптоматики желудочно-кишечного тракта, симптомов, связанных с аутизмом, и кишечной микробиоты, которая сохранялась не менее двух лет у детей с проблемами РАС и желудочно-кишечного тракта [Kang, 2019]. Пангборн и Бейкер [Pangborn, 2005] предположили, что нарушение пищеварения и мальабсорбция могут способствовать росту дисбиотической микрофлоры кишечника, воспалению и повышенной проницаемости кишечника, что может приводить к проникновению токсинов и казоморфинов. То есть белки, жиры и углеводы не расщепляются должным образом, чтобы всасываться через стенку кишечника. Множественный дефицит питательных веществ (например, цинка, магния, витамина B6) часто встречается у людей с аутизмом и может затруднять у них усвоение необходимых жирных кислот [Russo, 2011].
Сопутствующие заболевания аутизма и пикацизма были зарегистрированы в многочисленных исследованиях. Киннелл [Kinnell, 1985] считал пикацизм диагностическим признаком аутизма на основании исследования, в котором пикацизм был гораздо более распространен у людей с аутизмом (60%), чем у людей с синдромом Дауна (4%) (n = 70 в каждой группе). Как отмечалось ранее, Филдс и коллеги [Fields] обнаружили более низкий (но все же тревожный) уровень распространенности пикацизма у детей с РАС в возрасте от трех до пяти лет (23,2%).
Эти результаты привели авторов настоящего исследования к двум вопросам, не имеющим ответа:
-
Каковы относительные уровни распространенности конкретных симптомов и заболеваний ЖКТ в отношении пикацизма, аутизма и аутизма с пикацизмом у взрослых, проживающих в центрах развития?
-
Приближается ли уровень распространенности проблем с желудочно-кишечным трактом в выборке взрослых людей с аутизмом к показателям, опубликованных в недавних исследованиях о детях с аутизмом?
Методы
Участники
Данные были получены в результате Исследования по обеспечению качества медицинского персонала (QA), проведенного в Центре развития Лантерман для улучшения предоставляемых услуг лицам, демонстрирующим пикацизм. В постоянный пул клиентов были включены пациенты с диагнозом аутизм, аутизм с пикацизмом и пикацизм. Группы обследуемых были сопоставимы по полу и возрасту (см. таблицу 1), а также по уровню когнитивного функционирования (тяжелые и глубокие интеллектуальные нарушения). Все клиенты центра придерживались одинаковых диет. Имена людей не были включены в набор персональных данных.
Таблица 1. Пол и возраст диагностируемой группы
|
Аутизм |
Аутизм/пикацизм |
Пикацизм |
Контрольная группа |
|
| Муж | 12 | 12 | 10 | 10 |
| Жен | 3 | 5 | 6 | 6 |
| Средний возраст | 38.9 | 42.2 | 43.7 | 44.5 |
| Возраст СД* | 9.7 | 10.8 | 7.6 | 7.8 |
| Возрастной диапазон | 24-56 | 24-58 | 30-58 | 31-58 |
Демографические данные клиентов были получены авторами из компьютерной базы данных клиентов центра, а также из отчетов сотрудников из мест проживания. Первоначально в каждой из четырех групп было отобрано 16 случаев. В ходе исследования у одного человека из группы аутизма был обнаружен пикацизм, и впоследствии он был переведен в группу аутизм с пикацизмом. Групповое распределение было основано на следующих критериях включения:
-
Аутизм: пациенты включались в список, если они соответствовали диагностическим критериям аутистического расстройства [Diagnostic and statistical, 1994]. Диагнозы были поставлены перед исследованием как клиническим психологом, так и психиатром. Клиенты с пикацизмом были исключены.
-
Пикацизм: эти пациенты были идентифицированы первым автором посредством опроса и отчета как имеющие постоянные проблемы с пикацизмом. Среди проглоченных предметов были бусинки, пуговицы, бирки для одежды, резиновые перчатки, носки, шнурки, окурки, мелки, бумага, пластиковые предметы, ушки от алюминиевых банок, мусор, небольшие камни, кора, грязь, фекалии, трава, листья, грибы, веточки и т.д. Пациенты с аутизмом были исключены.
-
Аутизм и пикацизм: 14-ти из 16-ти пациентов поставили диагноз аутизм как клинический психолог, так и психиатр. В двух случаях один диагноз – аутизм, второй – ПРР (первазивное расстройство развития). Все 16 соответствовали критериям пикацизма (см. выше).
-
Контрольная группа: эти пациенты были сопоставлены по полу, возрасту и уровню когнитивного функционирования с группой пикацизма.
Измерения
Зависимые переменные для этого исследования включали симптомы и заболевания, связанные с ЖКТ. Список симптомов/заболеваний желудочно-кишечного тракта был составлен из медицинских учебников, материалов конференций и историй приема пациентов частнопрактикующими врачами (см. Приложение A). Этот контрольный список был проверен Комитетом по оценке и повышению качества медицинского персонала центра.
Сбор данных в центре проводили два стажёра-психолога из Калифорнийского университета в Лос-Анджелесе, которые были обучены умению вести поиск в медицинских документах клиентов за 10-летний период. Они не были проинформированы об истинной цели исследования.
Надежность выводов специалистов рассчитывалась путем деления количества совпадений между специалистами на количество совпадений плюс расхождений для четырех случайно выбранных диаграмм. Среднее соотношение для контрольного списка ЖКТ (признаки/симптомы/заболевания) составило 94%, что указывает на высокий уровень совпадений в выводах экспертов.
Исследование качества было одобрено Комитетом по оценке и улучшению качества медицинского персонала центра и Советом по управлению качеством Лантерман.
Результаты
Анализ распределений каждой из переменных выявил выброс и положительную асимметрию кривой распределения количества признаков/симптомов ЖКТ. Было выполнено логарифмическое преобразование (основание е), которое нормализовало эту асимметрию для использования в последующих анализах. Однако результаты были по существу такими же, если данные оставались нетрансформированными, или если выброс в группе аутизма с пикацизмом был исключен или винсоризирован.
Средние частоты заболеваний желудочно-кишечного тракта и признаков/симптомов желудочно-кишечного тракта в отношении групп аутизма с пикацизмом, аутизма и контрольных групп показаны в таблице 2.
Средняя и стандартная девиация (СД) для заболеваний/симптоматики по диагностической группе
|
|
Аутизм (n = 15) |
Аутизм/Пика (n = 17) |
Пикацизм (n = 16) |
Контр. Гр. (n = 16) |
||||
|
Сред. |
СД |
Сред. |
СД |
Сред. |
СД |
Сред. |
СД |
|
|
Заболевания ЖКТ |
0.53 |
.92 |
2.88 |
2.37 |
2.25 |
2.02 |
1.31 |
1.45 |
|
Симптомы ЖКТ * |
0.93 |
0.45 |
1.41 |
0.53 |
1.14 |
0.34 |
1.16 |
0.46 |
* логарифмическая трансформация (база е)
Многофакторный анализ был использован для изучения двух исходных переменных в отношении пикацизмa, аутизма и их взаимодействия в факторном дизайне два на два. Состояние пикацизма включало группы пикацизма и аутизма с пикацизмом, тогда как состояние отсутствия пикацизма включало как группы аутизма, так и контрольные группы. Состояние аутизма включало группы аутизма и аутизма с пикацизмом, тогда как условие отсутствия аутизма включало группы пикацизма и контрольные группы.
Многомерный анализ показал, что пикацизм был единственным значимым фактором, лямбда Уилкса = 0,816, F (2, 59) = 6,65, p = 0,002. Одномерный анализ показывает, что обе зависимые переменные существенно различают состояния пикацизма и отсутствия пикацизма. Заболевания желудочно-кишечного тракта были выше для состояния пикацизма, F (1, 60) = 13,34, p = 0,001, как и признаки/симптомы со стороны желудочно-кишечного тракта, F (1, 60) = 4,18, p = 0,045. Не было обнаружено значительных эффектов для состояния аутизма или взаимодействия между пикацизмом и аутизмом при многомерном анализе. Однако однофакторный анализ взаимодействий показал, что взаимодействие для симптомов ЖКТ было значительным, F (1,60) = 4,96, p = 0,030.
На рисунках 1 и 2 показаны средние значения для четырех групп заболеваний ЖКТ и признаков/симптомов ЖКТ соответственно. Оба рисунка, 1 и 2, отражают высокую частоту проблем с желудочно-кишечным трактом в группе аутизма с пикацизмом, но не в группе аутизма.
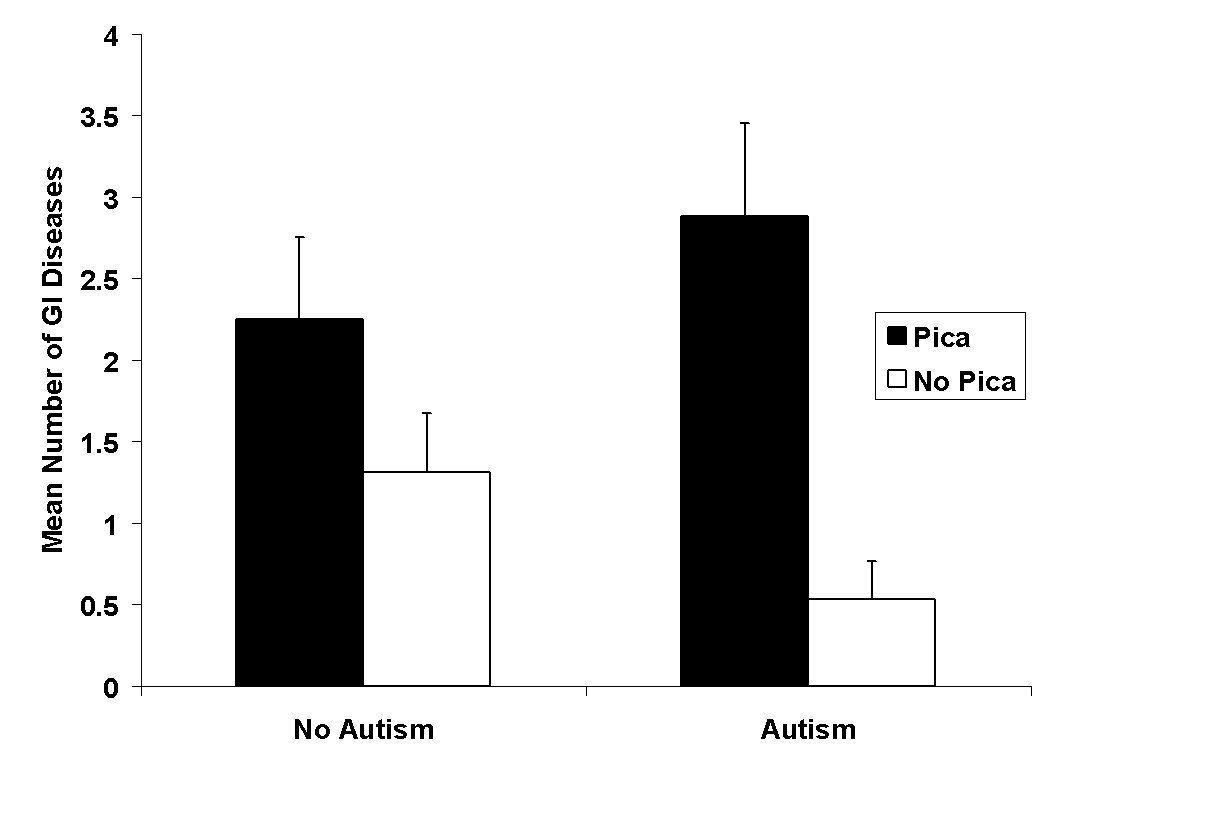
Диаграмма 1. Среднее количество заболеваний ЖКТ у пациентов с пикацизмом и аутизмом со стандартным отклонением
Анализ всех заболеваний желудочно-кишечного тракта у взрослых в условиях «пикацизм в сравнении с отсутствием пикацизма» показывает гораздо большую сопутствующую патологию заболеваний в состоянии пикацизма (см. рисунок 3).
[поместите рисунок 3 здесь]
Люди с тремя или более заболеваниями были определены как серьезно пораженные. Так можно идентифицировать почти половину тех, кто подвержен пикацизму.
Анализ конкретных видов заболеваний показывает преобладание хронических воспалительных заболеваний: гастрита, эзофагита, ГЭРБ, дуоденита и колита (см. таблицу 3).
[поместите Таблицу 3 здесь]
В состоянии Pica (n = 33) 64% людей имели по крайней мере одно из этих хронических воспалительных заболеваний, а 58% – по крайней мере два. Сравнение состояний пикацизм и отсутствие пикацизма отражает более высокую частоту пикацизма при всех этих заболеваниях: гастрите, эзофагите, ГЭРБ, дуодените, колите, грыже пищеводного отверстия диафрагмы, язве, H. pylori, кишечной непроходимости и аэрофагии.
Никаких существенных различий между пикацизмом и отсутствием пикацизма для наиболее часто встречающихся признаков/симптомов ЖКТ не наблюдалось. Таблица 4 показывает, что рвота, потеря веса/трудности с набором веса в анамнезе и желудочно-кишечные кровотечения возникали примерно с одинаковой частотой в двух состояниях.
[поместите Таблицу 4 здесь]
Однако значительная взаимосвязь между пикацизмом и аутизмом предполагает, что у взрослых с пикацизмом и аутизмом особенно высока частота желудочно-кишечных симптомов, включая такие признаки/симптомы как чередование диареи/запора, ночное пробуждение, спазмы в животе и хроническая/сезонная диарея (см. рисунок 2). Апостериорный t-тест (LSD – тест наименее значимого различия) показал, что среднее количество симптомов для группы аутизма с пикацизмом (1,41) было значительно больше, чем в среднем для группы только с аутизмом (0,93), t (30) = 3,02, p =. 004.
Обсуждение
Заболевание желудочно-кишечного тракта показало значительный общий эффект, связанный с пикацизмом, но не с аутизмом. Люди с диагнозом пикацизм имели в 2,8 раза больше заболеваний желудочно-кишечного тракта и в 4,8 раза чаще серьезно страдали. Люди с пикацизмом имели в среднем 2,6 заболевания желудочно-кишечного тракта по сравнению с 0,9 у людей без пикацизма. Как показано в таблице 3, взрослые с пикацизмом показали более высокую распространенность каждого из 10 наиболее часто регистрируемых заболеваний желудочно-кишечного тракта.
В своих выводах Валиченти-Макдермотт и коллеги [44, с. S135] заявляют: «Желудочно-кишечные симптомы кажутся частой коморбидностью аутизма. Специфические симптомы со стороны желудочно-кишечного тракта могут помочь идентифицировать фенотипическую подгруппу в гетерогенной группе людей, которые соответствуют определенным поведенческим критериям аутизма». Следует отметить, что Валиченти-Макдермотт и коллеги обнаружили, что в условиях, в которых были набраны люди, не отсутствовала предвзятость к симптомам желудочно-кишечного тракта, таким образом поддержав обобщаемость результатов. Однако их исследование не касалось пикацизма. Наблюдаемое в текущем исследовании значительная корреляция между аутизмом и пикацизмом по симптомам желудочно-кишечного тракта, предполагает, что важно различать диагностические группы аутизма и аутизма/пикацизма. О типах индикаторов, используемых Валиченти-Макдермотт и коллегами. группа аутизма с пикацизмом в текущем исследовании имела более высокий уровень дисфункции желудочно-кишечного тракта, чем группа только аутизма; то есть ГЭРБ (35% против 7%), рвота (41% против 27%), боль в животе (29% против 0%), запор (94% против 80%) и чередование диареи/запора (29% против 7%). Данные убедительно свидетельствуют о том, что высокая частота симптомов со стороны желудочно-кишечного тракта, наблюдаемая у людей с аутизмом, может быть объяснена пикацизмом.
Оусли и Сермак отметили, что «изучение желудочно-кишечных расстройств… начало давать представление о патофизиологии четко определенных медицинских/генетических подгрупп РАС» [Ousley, 2014, с. 5]. На самом деле, наше исследование предполагает, что люди с аутизмом и пикацизмом могут быть фенотипической подгруппой. В своем всеобъемлющем отчете Бьюи и коллеги [Buie, 2010] отметили: «Учитывая гетерогенность людей с РАС и множество противоречивых результатов исследований, касающихся РАС, крайне важно, чтобы фенотип (биологические, клинические и поведенческие особенности) будущих субъектов исследования был четко определен [Buie, 2010, с. 13]. Кури и коллеги [Coury, 2012] включали «поведенческие фенотипы, связанные с плохим питанием». Они указали на создание клинических алгоритмов категоризации и эффективного лечения.
С точки зрения поведенческого анализа, которая ориентировочно, но многообещающе распространяется на новые исследования кишечника людей с аутизмом и микробиома, мы предлагаем концептуализировать пикацизм здесь, прежде всего, как часть цепи событий:
(1) постоянное исследовательское помещение в рот объектов, связанное с сенсорным подкреплением, сенсорная чувствительность [Ristori, 2019; Spek, 2020], сенсорная гиперчувствительность, сенсорная тяга и нарушение обработки сенсорной информации [Edelson, 2019; Edelson, 2016],
(2) попадание в организм вредных бактерий, метаболиты которых могут повлиять на организм и мозг [Kang, 2019; Kang, 2017; Krajmalnik-Brown, 2015; Xu, 2019],
(3) неправильное пищеварение и мальабсорбция или нарушение обмена веществ [Horvath, 1999; Pangborn, 2005],
(4) дефицит питательных веществ [Ristori, 2019] и дефицит питательных микроэлементов [Miao, 2015],
(5) расстройство желудочно-кишечного тракта,
(6) симптоматика желудочно-кишечного тракта и воспаление (со временем ухудшение)
(7) заболевание желудочно-кишечного тракта.
Более полная модель, без сомнения, будет включать петли обратной связи, например, поведение пикацизма, влияющее на пищеварение и всасывание. Авторы предлагают концептуализировать дефицит питательных веществ и дисбаланс как «операцию по установлению», для пикацизма, а также тот факт, что оценка питания и желудочно-кишечного тракта может принести пользу людям, у которых обнаруживается пикацизм.
Пика может быть только «верхушкой айсберга», потому что такое поведение может служить маркером симптоматики и заболевания ЖКТ. Риски, связанные с этими основными дисфункциями и с дисбактериозом, могут быть больше, чем риски, связанные с большинством физических актов проглатывания. В отличие от более ранних исследований распространенности заболеваний, связанных с пикацизмом [Danford, 1982; Danford, 1982а], в данном исследовании особое внимание уделяется возникновению и сочетанию хронических воспалительных заболеваний. В этом исследовании более высокие средние значения как для заболеваний желудочно-кишечного тракта, так и для признаков/симптомов желудочно-кишечного тракта для группы аутизма с пикацизмом по сравнению с группой пикацизма, как показано в таблице 2, могут свидетельствовать о том, что патофизиология аутизма, хотя и не полностью изучена, в дальнейшем интерактивно влияет на процессы болезни. Взрослых с пикацизмом (с аутизмом и без него), но не только с аутизмом, сравнивают с серьезно затронутыми детьми в недавних публикациях по аутизму. В связи с этими публикациями показана репликация текущего исследования, в котором основное внимание уделяется детям только с пикацизмом, только аутизмом и аутизмом и пикацизмом. В других планах исследования следует рассмотреть возможность включения этих групп в целях сравнения вместе с людьми с аутизмом с расстройствами желудочно-кишечного тракта и без них.
И в литературе по пике и по аутизму предлагаются многообещающие специфические и разнообразные методы работы с пищевым поведением (диеты) для изменения биохимического дисбаланса и паттернов аберрантного поведения. Исследователи смогли уменьшить пикацизм с помощью добавок железа [Gutelius, 1962], жидких поливитаминов, поливисола [Pace, 2000], а также Standard Vivonex, - продукта, содержащего все основные питательные вещества в легко усваиваемой форме [Bugle, 1993]. В литературе по аутизму сообщается о клиническом улучшении при использовании антиоксидантной терапии (витамин C, E, B-6, магний и марганец, если это необходимо) и добавок цинка (в виде пиколината Zn) [Russo, 2011], а также при использовании фолиновой кислоты, бетаина и метилового спирта. B-12 для решения проблем повышения оксидативного стресса и нарушения метилирования [James, 2004]. Эти результаты особенно важны в свете вывода Кури и коллег [Coury, 2012] по 12-ти исследованиям качества питания детей в спектре аутизма: «Коллективно на сегодняшний день это указывает на тенденцию к клинически значимому субоптимальному потреблению питательных веществ у детей с РАС..».
Совсем недавно Ристори и коллеги [Ristori, 2019] исследовали аутизм, симптомы со стороны желудочно-кишечного тракта и модуляцию микробиоты кишечника с помощью лечения диетами. Их упор на ярко выраженную чувствительность к запаху, вкусу, текстуре, внешнему виду пищи и избирательность в еде может коррелировать с определенными пристрастиями, связанными с пикацизмом [Spek, 2020; Toguleva, 2018]. Например, предсказывает ли выраженная чувствительность/избирательность в еде, такая как предпочтения текстуры (например, леденцы, твердые предметы; жевательные продукты, пластмассы, пеноматериалы или резина) пикацизм? В более ранних публикациях высказывается предположение, что пикацизм может представлять собой ранний, если не самый ранний образец зависимости [Lourie, 1958]. Недавние исследования о пикацизме и токсикомании рассматривают возможную связь [Hull, 2020]. Физиологическое описание зависимости, предоставленное Рэйти и Хагерманом, может дать объяснение: «… базальные ганглии работают на автопилоте, когда вы видите/слышите/нюхаете/чувствуете стимулы. Префронтальная кора не может подавлять ваши действия, даже если вы, возможно, знаете иное…» [Ratey, 2008, с. 172]. Другими словами, пикацизм может быть «неспособностью подавить «ненормальную» стимуляцию, а не выбором для получения определенных стимулов» [Miller, 2016, с. 143]. Если это так, мы ясно указываем на попытки ранней идентификации, чтобы уменьшить влияние на траекторию развития [Barhrick, 2012].
Наконец, многообещающее новое вмешательство, основанное на переносе микробиоты для изменения экосистемы кишечника, может быть направлено не только на детей с РАС, но и на детей с пикацизмом. «Бактериальный и фаговый глубокий анализ секвенирования выявил успешное частичное приживление донорской микробиоты и благоприятные изменения в кишечной среде» [Kang, 2017, с. 1] (см. также [Kang, 2019]). В текущем исследовании бактериальная инфекция и язва H. pylori наблюдались у 15% комбинированной группы пикацизма по сравнению с 0% и 3% в комбинированной группе отсутствия пикацизма. Гастрит был выявлен с помощью обзора диаграммы у 58% пациентов из группы пикацизма по сравнению с 26% из группы отсутствия пикацизма, то есть более чем в два раза чаще. Тогда терапия переноса микробиоты может быть вариантом для дисбиотических экосистем кишечника, связанных с пикацизмом.
Выводы
Хотя настоящая работа ограничивалась обзорами диаграмм, она поднимает как исследования, так и проблемы лечения, касающиеся пикацизма и аутизма. Разрыв в распространенности коморбидности между 23,2% у детей и 60% у взрослых должен быть устранен с помощью поперечного и лонгитюдного исследований [Fields; Kinnell, 1985; Morozov, 2018]. Хотя сообщаемая распространенность расстройств желудочно-кишечного тракта у детей с РАС колеблется от 9% до 70% или выше, потенциальные проблемы с пикацизмом обычно не рассматриваются при оценке РАС [Coury, 2012]. Анализ опросов взрослых и детей необходим для точного определения распространенности аутизма, пикацизма и аутизма с пикацизмом среди конкретных групп населения.
Онлайн-набор инструментов для профессионалов описывает многогранный подход к диагностике, лечению и профилактике пикацизма [McAdam, 2014]. Основываясь на результатах этого исследования и текущих публикациях, мы предлагаем включить дополнительные нейрометаболические показатели, такие как соотношение меди/цинка, микроэлементы, незаменимые жирные кислоты, ГАМК, дофамин-бета-гидроксилаза, серотонин, адреналин и норэпинефрин. Критическая «ось поведения кишечника» включает нервные, гормональные, иммунные и метаболические пути [Berding, 2016; Srikantha, 2019]. Индивидуальный подход к метаболической терапии кишечной микробиоты может иметь важное значение [Polyakova, 2019]. Кроме того, мы предлагаем поведенческую аналитическую основу для рассмотрения развития пика в многомерной цепочке событий с петлями обратной связи. Кроме того, разработка любой комплексной стратегии лечения должна включать анализ истории болезни как одного компонента и истории поведения как другого [Coury, 2012].
В соответствии с консенсусным утверждением Буйе [Buie, 2010], авторы настоящей статьи рекомендуют направление к гастроэнтерологу при новом диагнозе аутизма, пикацизма или сопутствующей патологии. Диагностически пикацизм может указывать на недиагностированные симптомы или заболевание желудочно-кишечного тракта, или, наоборот, они также могут проявляться и сопутствующими заболеваниями. Таким образом, пикацизм можно рассматривать как поведенческий индикатор, важный для выявления факторов риска проблем с ЖКТ. Оценка микроэлементов также может быть включена в медицинский осмотр. Если результаты выходят за пределы допустимого диапазона или не сбалансированы, изменение рациона питания имеет важное значение как часть общей стратегии лечения. Такое вмешательство может усилить, если не заменить, более быстро внедряемое поведенческое вмешательство, но не связано с некоторыми из тех же проблем, таких как обучение персонала, стоимость и доступность, отказ от лечения, экологические ограничения и вопросы, связанные с обобщением и поддержкой [Williams, 2012]. Карбоне [Carbone, 2013] и Буйе с коллегами [Buie, 2010а] также подчеркнули важность сосредоточения как на медицинской, так и на поведенческой оценке и лечении.
Пикацизм – это критическая проблема, которая крайне недостаточно представлена в исследованиях, особенно с учетом рисков, которые он представляет, и биологические подходы составляют лишь очень небольшой процент от всех исследований пикацизма на сегодняшний день. Следующие важные шаги могут включать сравнение биомаркеров окислительного стресса и способности метилирования [James, 2004] в четырех группах в этом исследовании, а также получение сравнительных данных по индексам микробиома [Kang, 2017]. Дальнейшие исследования также должны быть сосредоточены на лабораторном анализе микроэлементов, незаменимых жирных кислот и метаболических показателей, соотношении медь/цинк и незаменимых жирных кислот. ГАМК, дофамин-бета-гидроксилаза, адреналин и норэпинеферин также представляют интерес. Дефицит затем можно таргетированно или глобально устранять с помощью добавок или, если показано, с помощью терапии переноса микробиоты [Kang, 2019] для нормализации химического состава тела, а также можно использовать поведенческие вмешательства для уменьшения или устранения опасного для здоровья поведения.