Введение
На современном этапе пандемии ВИЧ существование специфических ВИЧ-ассоциированных нейрокогнитивных расстройств (ВАНР) не вызывает сомнений, их проявления наблюдаются у 30–50% больных [Трофимова, 2018; Sacktor, 2001]. Нейрокогнитивные нарушения при ВИЧ-инфекции имеют большую социальную значимость, так как их наличие повышает вероятность дезадаптации в социуме, приводит к снижению профессиональных навыков человека и к ограничению его повседневной активности [Акулова, 2015; Махаматова, 2016]. Было показано, что для ВАНР характерны прежде всего исполнительная дисфункция и нарушения эпизодической памяти [16; 24; 25; 32; 37], которые приводят к снижению комплаентности пациентов и меньшей приверженности к антиретровирусной терапии (АРТ), однако механизм их развития до конца не ясен.
В этом отношении несомненна актуальность исследования патогенетических механизмов психоэмоциональных и когнитивных нарушений при ВИЧ-инфекции. Для решения этой задачи необходимы методы, оценивающие функциональное состояние головного мозга. «Золотым стандартом» в этом отношении является метод позитронно-эмиссионной томографии (ПЭТ) с 18F-фтордезоксиглюкозой (ФДГ). Поскольку ФДГ проходит те же метаболические пути в нервной ткани, что и обычная глюкоза, являющаяся универсальным энергетическим метаболитом для головного мозга, накопление ФДГ позволяет оценить функциональную активность ткани. Подробно стандартная процедура ПЭТ описана в работе Г.В. Катаевой и коллег [Катаева, 2007]. ПЭТ с ФДГ успешно применяется в диагностике широкого спектра неврологических и других заболеваний [Медведев, 2008]. В последние десятилетия широкое распространение получил метод магнитно-резонансной томографии (МРТ), который, помимо исследования структуры органов, может дать информацию об их биохимическом составе с помощью магнитно-резонансной спектроскопии (МРС).
В данный момент количество метаболитов, содержание которых в тканях можно оценить с помощью МРС, ограничено. Тем не менее их изучение представляет интерес, поскольку позволяет дать оценку содержания этих веществ в живой ткани. Один из основных метаболитов, наиболее хорошо различимый в МР-спектре и имеющий большое значение для функционирования нервной ткани, – N-ацетиласпартат (NAA), который содержится в нейронах и считается маркером нейрональной целостности. При заболеваниях, сопровождающихся разрушением нервной ткани, наблюдается снижение концентрации NAA [Barker, 2009]. В связи с техническими особенностями метода МРС определение абсолютных концентраций веществ в живой ткани затруднено, поэтому обычно используются относительные показатели. В качестве референта обычно применяют комбинированный пик креатина (Cr) и фосфокреатина, поскольку считается, что его концентрация в тканях головного мозга достаточно постоянна. Таким образом, на практике оценивается отношение NAA/Cr [Barker, 2009].
В наших предыдущих работах было показано, что уже на ранних стадиях ВИЧ-инфицирования по данным ПЭТ с ФДГ и МРС обнаруживаются изменения метаболизма в тканях головного мозга, при этом у пациентов с бессимптомной ВИЧ-инфекцией изменения функционального состояния головного мозга определялись в передней поясной коре [2–4]. Прогрессирование заболевания с коинфекцией хронического гепатита С сопровождалось распространением гипометаболизма на конвекситальную лобную кору и хвостатые ядра. При этом в исследуемых группах влияния АРТ на церебральный метаболизм не выявлено.
Цель работы: изучение структурно-функциональных параллелей при развитии когнитивного и психоэмоционального дефицита у ВИЧ-инфицированных пациентов по данным ПЭТ с ФДГ и МРС.
Материалы и методы исследования
Работа базируется на выполненном в Институте мозга человека им. Н.П. Бехтеревой обследовании ВИЧ-инфицированных пациентов (38 человек в возрасте 25–45 лет). Пациенты составили три группы: в группу 1 вошли пациенты, принимавшие АРТ, с содержанием лимфоцитов СD4≥500 единиц, в группу 2 – пациенты, принимавшие АРТ, но с СD4≤500, в группу 3 – пациенты, не принимавшие АРТ. Подробная характеристика групп представлена в табл. 1. Перед исследованием было получено письменное информированное согласие всех пациентов.
Таблица 1
Клинико-лабораторные данные пациентов трех групп
|
Показатель |
Не принимали АРТ |
Принимали АРТ |
|
|
Группа 1 |
Группа 2 |
Группа 3 |
|
|
Возраст, лет |
31,1±5,4 |
32,4±7,9 |
30,4±7,4 |
|
Длительность заболевания, мес. |
29,7±18,9 |
27,6±19,8 |
60,4±11,7 |
|
Концентрация |
599±54 |
352±75 |
409±92 |
|
Количество человек |
12 |
14 |
12 |
|
Пол: М/Ж |
7/5 |
9/5 |
8/4 |
Критерии исключения для всех групп: употребление психоактивных веществ; необходимость сопутствующей терапии средствами, оказывающими влияние на функциональные показатели ЦНС; неврологические заболевания, не связанные с ВИЧ; беременность; психические заболевания до заражения ВИЧ; поражение головного мозга оппортунистическими инфекциями.
Психологическое исследование проводилось с помощью следующих методик.
-
Таблицы Шульте – 5 таблиц с хаотичным размещением в них чисел от 1 до 25. Суть работы с данной таблицей – быстрое нахождение всех последовательных чисел. В норме у здорового человека на это уходит 30–50 секунд. По результатам высчитывался показатель «эффективность работоспособности» (ЭР): ЭР=(Т1+Т2+Т3+Т4+Т5)/5, где Тi — время работы с i-ой таблицей.
-
Шкала памяти Векслера – психометрический метод оценки памяти, включающий в себя ряд заданий, позволяющих дать профильную оценку состояния отдельных мнестических функций (ориентирования в пространстве и времени, логической памяти, парных ассоциаций и др.).
-
Для оценки психологических нарушений использовался Опросник выраженности психопатологической симптоматики (SCL-90-R), разработанный Л.Р. Дерогатис [Derogatis, 1977] и адаптированный Н.В Тарабриной [Тарабрина, 2001]. Опросник содержит 9 шкал: SOM – соматизация, OCD – обсессивность/компульсивность, INT_ANX – межличностная тревожность, DEPR – депрессивность, ANX – тревожность, HOS – враждебность, FOB – фобии, PAR – паранойяльность, PSY – психотизм. Измерялся общий индекс тяжести GSI (Global Severity Index) психопатологической симптоматики, являющийся индикатором текущего состояния и отражающий уровень психического дистресса.


МРТ выполнялось на томографе Philips Achieva 3T со стандартной 8-канальной катушкой для исследования головного мозга и включало Т1, Т2 и постконтрастное сканирование для исключения очаговой патологии. МРС в суправентрикулярной области проведена по программе 2D-PRESS (TR=2000 ms, TE=144 ms), размер воксела – 10*10*15мм. Для оценки спектров использовалась программа SpectroView (Philips). Область исследования включала белое вещество суправентрикулярной области и серое вещество медиальной коры (рис. 1). Вокселы, которые попали на границу белого и серого вещества, исключались из анализа.
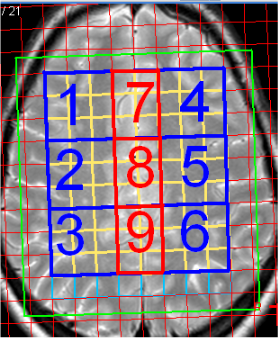
Рис. 1. А – анатомическое расположение вокселов; Б – группировка вокселов по 9 областям интереса: 1-6 – в проекции белого вещества суправентрикулярной области, 7-9 – в проекции серого вещества медиальной коры
ПЭТ проводилась на томографе Philips GeminiTF Base16. Радиофармпрепарат 18F-ФДГ вводили внутривенно в дозе 4-5 mCi. Сканирование длительностью 10 минут начиналось через 30-40 мин после введения. Для анализа скорости метаболизма глюкозы (СМГ) индивидуальные изображения приводились к стандартному анатомическому координатному пространству MNI Space [Evans, 1994], для чего использовались программы Statistical Parametric Mapping (SPM-8) [Statistical Parametric Mapping]. Затем при помощи WFUPicAtlas [WFU PickAtlas. [Электронный] вычислялись средние значения накопленной активности в полях Бродмана (ПБ). Подробное описание методики представлено в работе Г.В. Катаевой и коллег [Катаева, 2007]. Для анализа результатов применялась нормализация накопленной активности в ПБ на среднюю накопленную активность во всем головном мозге.
Статистический анализ (однофакторный дисперсионный анализ с post-hoc процедурой методом Тьюки и корреляционный анализ по Спирмену) проводился с использованием Statistica V. 11. Валидность применения дисперсионного анализа – проверка нормальности распределения и гомогенности дисперсий проводились при помощи теста Шапиро–Вилка и критерия Ливиня.
Проверка на множественность сравнений результатов корреляционного анализа по Спирмену проводилась с помощью метода определения «частоты ложных обнаружений» false discovery rate (FDR) [Benjamini, 1995]. P считалось значимым, если соблюдались следующие условия: p<(i/m)Q, где i – ранг p (наименьшее p имеет ранг, равный 1, следующий меньший – 2 и так далее), m – количество сравнений, – требуемый уровень значимости. Согласно J.H. McDonald, Q принималось равным 0,05 [McDonald, 2014].
СМГ во многих областях коры больших полушарий коррелируют между собой, что отражает особенности их функциональных связей. Поскольку методы проверки на множественность сравнений рассчитаны на выборки с независимыми переменными [McDonald, 2014], а показатели СМГ в разных полях Бродмана не являются независимыми друг от друга, они не рассматривались как разные переменные при определении FDR. Таким образом, при проверке на множественность сравнений при сопоставлении данных психологических тестов и ПЭТ количество проверяемых гипотез считалось равным количеству шкал тестов.
Следует отметить, что, согласно J.H. McDonald [McDonald, 2014], коррекция на множественность сравнений не всегда целесообразна: эта процедура проводится для того, чтобы снизить вероятность ложно положительных результатов, однако в случае проверки большого количества гипотез (сравнения большого количества показателей) она будет приводить к потере значимых результатов. В этом отношении даже в случае, если результаты не проходят проверку на множественность сравнений, но могут иметь практическое значение, целесообразно их публиковать с указанием на то, что они могут оказаться случайными. При этом проверкой таких результатов будут служить не математические методы, а воспроизводимость результатов в других исследованиях.
Межгрупповое сравнение показателей проводилось с помощью однофакторного дисперсионного анализа с post-hoc процедурой методом Тьюки, который не требует дополнительной проверки на множественность сравнений.
Результаты
Подробно показатели нейровизуализационных методов исследования (ПЭТ и МРС) и их сравнение в разных группах были опубликованы в предыдущих работах [Гайсина, 2016; Громова, 2016]. Данная статья посвящена анализу психологических особенностей и сопоставлению их с данными ПЭТ и МРС.
Значимых различий между группами по результатам тестирования при помощи таблиц Шульте и текста Векслера выявлено не было. Показатели тестов представлены в табл. 2.
Таблица 2
Результаты тестов Векслера и Шульте в обследованных группах
|
Шкала |
Группа 1 |
Группа 2 |
Группа 3 |
|||
|
Среднее |
SD |
Среднее |
SD |
Среднее |
SD |
|
|
Эквивалентный показатель памяти |
100,70 |
11,94 |
112,64 |
17,97 |
108,29 |
16,34 |
|
Оперативная память |
5,90 |
1,45 |
6,55 |
2,02 |
6,14 |
2,27 |
|
Кратковременная слуховая память |
12,40 |
1,65 |
12,09 |
2,26 |
12,00 |
1,00 |
|
Логическая память |
10,55 |
3,18 |
10,55 |
3,80 |
13,57 |
4,43 |
|
Зрительная память |
7,60 |
3,50 |
11,00 |
2,79 |
10,43 |
2,07 |
|
Ассоциативная память |
13,50 |
3,57 |
14,50 |
4,37 |
13,14 |
3,15 |
|
Тест «10 слов» |
8,56 |
1,67 |
7,73 |
2,37 |
8,00 |
2,45 |
|
Устойчивость внимания |
1,03 |
0,08 |
0,96 |
0,13 |
0,91 |
0,09 |
|
Эффективность работоспособности |
35,80 |
6,47 |
35,60 |
6,94 |
36,57 |
5,91 |
Однако были выявлены корреляции между скоростью метаболизма
глюкозы
и баллами по отдельным шкалам (табл. 3). Корреляции были определены во всей
группе пациентов в целом.
Таблица 3
Коэффициенты корреляции показателей когнитивных тестов и СМГ (p<0,05)
|
Показатели |
Поля Бродмана (в скобках – коэффициент корреляции) |
|
|
Левое полушарие |
Правое полушарие |
|
|
Эквивалентный показатель памяти |
ПБ10 (0,44); p=0,009 ПБ11 (0,40); p=0,022 ПБ46 (0,35); p=0,045 |
ПБ10 (0,43); p=0,010 ПБ46 (0,40); p=0,023 |
|
Ассоциативная память |
ПБ47 (0,40); p=0,018 |
- |
|
Эффективность работоспособности |
ПБ23 (-0,41); p=0,021 ПБ24 (-0,47); p=0,007 ПБ26,29,30 (-0,43); p=0,013 ПБ32 (-0,35); p=0,047 |
ПБ24 (-0,36); p=0,043 ПБ26,29,30 (-0,59); p=0,005 ПБ32 (-0,50); p=0,003 |
Обращают на себя внимание корреляции показателей когнитивных тестов с СМГ в областях коры, связанных с исполнительными функциями (лобная, в том числе орбитофронтальная кора, лимбическая кора). Показатель эффективности работоспособности по тесту Шульте отрицательно коррелировал с функциональной активностью поясной коры. Таким образом, более быстрое выполнение теста было ассоциировано с лучшим функциональным состоянием поясной коры.
Психоэмоциональное состояние пациентов. При анализе результатов психологического тестирования было выявлено, что уровень дистресса по данным Опросника выраженности психопатологической симптоматики по ряду показателей превышает нормативные значения, что совпадает с результатами, полученными в исследовании А.В. Гайсиной [Гайсина, 2016]. В группе 1 повышенные значения встречались только по нескольким шкалам, в группах 2 и 3 – по всем шкалам (табл. 4). При этом следует отметить достаточно большой разброс показателей внутри каждой группы, что говорит о неоднородности групп по степени выраженности и типу преобладающей психопатологической симптоматики.
Межгрупповые различия соматизации можно объяснить двумя факторами: положительной корреляционной связью между уровнем соматизации и длительностью заболевания (r=0,6; p<0,05) и отрицательной зависимостью между баллами по шкале соматизации и уровнем CD4-лимфоцитов (r=-0,5, p<0,05). Непосредственного влияния уровня вирусной нагрузки на выраженность соматизации выявлено не было. Очевидно, что уровень дистресса увеличивался при прогрессировании заболевания, что может быть связано как с психоэмоциональным фактором, так и с повреждающим действием ВИЧ-инфекции на ЦНС. Для проверки этого предположения данные тестов были сопоставлены с данными ПЭТ и МРС.
Таблица 4
Баллы по шкалам Опросника выраженности психопатологической симптоматики в обследованных группах пациентов
|
Шкала |
Нормативные показатели |
Группа 1 |
Группа 2 |
Группа 3 |
|||
|
Среднее |
SD |
Среднее |
SD |
Среднее |
SD |
||
|
SOM |
0,36 |
0,33 |
0,30 |
0,64* |
0,57 |
0,88* |
0,36 |
|
OCD |
0,39 |
0,39 |
0,19 |
0,74 |
0,45 |
0,81* |
0,52 |
|
INT_ANX |
0,29 |
0,27 |
0,21 |
0,70* |
0,60 |
0,57 |
0,37 |
|
DEPR |
0,36 |
0,33 |
0,35 |
0,76* |
0,46 |
0,60* |
0,36 |
|
ANX |
0,30 |
0,23 |
0,13 |
0,68* |
0,55 |
0,43* |
0,46 |
|
HOS |
0,30 |
0,43 |
0,41 |
0,50 |
0,50 |
0,59 |
0,45 |
|
FOB |
0,13 |
0,29 |
0,21 |
0,48 |
0,38 |
0,51 |
0,07 |
|
PAR |
0,34 |
0,50 |
0,00 |
1,17 |
0,81 |
0,67 |
0,17 |
|
PSY |
0,14 |
0,25 |
0,30 |
0,47 |
0,32 |
0,20 |
0,08 |
|
GSI |
0,31 |
0,25 |
0,15 |
0,55 |
0,44 |
0,55 |
0,24 |
Примечание: * – значения достоверно выше (p<0,05) по сравнению со значениями группы 1. SOM – соматизация, OCD – обсессивность/компульсивность, INT_ANX – межличностная тревожность, DEPR – депрессивность, ANX – тревожность, HOS – враждебность, FOB – фобии, PAR – паранойяльность, PSY – психотизм, GSI –психопатологической симптоматики.
Для сопоставления показателей дистресса с данными ПЭТ и МРС был проведен корреляционный анализ баллов по шкалам Опросника выраженности психопатологической симптоматики с СМГ, результаты представлены в табл. 5.
Таблица 5
Результаты корреляционного анализа показателей дистресса и СМГ (p<0,05)
|
Шкалы опросника |
Поля Бродмана (в скобках – коэффициент корреляции) |
|
|
Левое полушарие |
Правое полушарие |
|
|
SOM |
ПБ4 (0,52); p=0,003 |
- |
|
OCD |
ПБ9 (0,37); p=0,049 ПБ41-43 (0,43); p=0,021 ПБ45 (0,42); p=0,025 |
ПБ20 (-0,40); p=0,030 |
|
INT_ANX |
ПБ41-43 (0,40); p=0,033 |
- |
|
DEPR |
- |
ПБ11 (-0,39); p=0,036 |
|
ANX |
ПБ41-43 (0,41); p=0,028 ПБ45 (0,52); p=0,004 |
- |
|
HOS |
ПБ26,29,30 (0,40); p=0,040 ПБ32 (0,48); p=0,013 ПБ45 (0,42); p=0,032 |
ПБ24 (0,39); p=0,049 ПБ32 (0,50); p=0,010 |
|
FOB |
- |
- |
|
PAR |
- |
- |
|
PSY |
- |
ПБ46 (0,50); p=0,008 |
|
GSI |
ПБ4 (0,39); p=0,032 |
- |
Примечание: расшифровку шкал тестов см. в примечании к табл. 4.
Корреляционный анализ показателей Опросника выраженности психопатологической симптоматики и NAA/Cr в медиальной коре и в прилежащем к ней белом веществе выявил взаимосвязи в основном в передней поясной коре и прилежащем к ней белом веществе (табл. 6).
Таким образом, были выявлены положительные корреляции показателей шкал опросника с СМГ в лобной, височной и поясной коре, частично совпадающие с теми, гипометаболизм в которых соответствовал более низким показателям когнитивных функций. В первую очередь, это может свидетельствовать о том, что и развитие когнитивной дисфункции, и развитие психопатологической симптоматики связаны с одними и теми же зонами коры больших полушарий, причем известно, что эти области коры отвечают за исполнительные функции [Kübler, 2006]. При этом более высокая функциональная активность лобной и поясной коры, совпадающая с более выраженной психопатологической симптоматикой, может говорить о повышенной, «чрезмерной» активности этих областей, ассоциированной с психопатологическими проявлениями. В то же время чрезмерная активация поясной коры ассоциирована со снижением некоторых когнитивных показателей.
Таблица 6
Коэффициенты корреляции показателей Опросника выраженности психопатологической симптоматики с NAA/Cr по данным МРС
|
Правое полушарие |
Медиальная кора |
Левое полушарие |
|
БВ 1 GSI (0,57); p=0,007 DEPR (0,48); p=0,030 OCD (0,54); p=0,013 |
СВ 7 GSI (0,62); p=0,003 PAR (0,46); p=0,035 OCD (0,59); p=0,005 HOS (0,62); p=0,008 |
БВ 4 GSI (0,51); p=0,002 SOM (0,65); p=0,001 ANX (0,56); p=0,010 DEPR (0,66); p=0,002 |
|
БВ 2 ANX (0,46); p=0,021 INT_ANX (0,50); p=0,023 |
СВ 8 OCD (0,51); p=0,017 INT_ANX (0,53); p=0,021 |
БВ 5 - |
|
БВ 3 - |
СВ 9 OCD (0,45); p=0,048 INT_ANX (0,48); p=0,033 |
БВ 6 - |
Примечание: БВ – вокселы в проекции суправентрикулярного белого вещества, СВ – вокселы в проекции медиальной коры, согласно рис. 1. В скобках указаны коэффициенты корреляции. Расшифровку шкал тестов см. в примечании к табл. 4.
Может существовать и другое объяснение, связанное с особенностями регистрации выраженности психопатологической симптоматики, когда сам пациент должен по баллам оценить ее наличие. При этом низкие показатели психопатологической симптоматики могут быть зарегистрированы у следующих пациентов:
-
пациенты, у которых нет психопатологической симптоматики;
-
пациенты, отрицающие наличие психопатологических симптомов из-за снижения критики к своему состоянию, у которых фактически наблюдаются более выраженные изменения психики, но они не регистрируются при заполнении опросника. У таких пациентов гипотетически можно ожидать более низкие показатели СМГ в лобных областях, что и будет давать прямые корреляции
с баллами по описываемому тесту. -
пациенты, которые не настроены отвечать правдиво в силу протестных реакций, либо высокого уровня конформности и стремления дать социально приемлемые ответы.
Согласно данным ряда исследователей, у ВИЧ-инфицированных пациентов могут иметь место недооценка тяжести и низкая тревога в отношении собственного заболевания [Незнанов, 2010; Незнанов, 2018; Jiang, 2016]. Кроме того, могут быть преморбидные особенности личности, связанные с тенденцией к антисоциальному поведению. С этими фактами согласуется возможность наличия в группе значительного количества пациентов, недооценивающих свое состояние, либо не дающих правдивых ответов. Причем, согласно ПЭТ и МРС, у таких пациентов наблюдаются более низкие показатели функционального состояния ряда областей коры, ассоциированные также с худшим когнитивным статусом.
Тот факт, что в данной работе получены положительные корреляции с СМГ в областях коры головного мозга, ответственных за исполнительные функции, может говорить о том, что в целом наличие высоких баллов по Опроснику выраженности психопатологической симптоматики является признаком относительной сохранности когнитивных функций пациента и высокого уровня его комплаентности, склонности к сотрудничеству. С другой стороны, высокие значения баллов по этой шкале могут иметь противоположное значение, отражая высокий уровень дистресса и психопатологической симптоматики, поэтому должны оцениваться только в комплексе с другими методами. Таким образом, представляется необходимым ввести в практику психологического обследования тесты, которые были бы основаны не только на субъективной оценке пациентом своего состояния, которые предполагают, что пациент достаточно хорошо осознает свое состояние, может его вербализовать и готов сообщить об этом. В этом отношении представляется целесообразным оценить диагностические возможности проективных методик и полной версии теста Люшера для исследования психологического статуса таких пациентов, а также применять объективные методики для оценки психофизиологического состояния.
Вместе с тем некоторые показатели опросника отрицательно коррелировали с СМГ в лобной (ПБ11) и височной коре (ПБ 20). Так, уровень депрессивности отрицательно коррелировал с СМГ в ПБ11 правого полушария. В данном случае это может объясняться тем, что ухудшение исполнительных функций провоцирует развитие депрессивной симптоматики. Это не противоречит литературным данным: согласно H. Su и соавторам, при депрессии обнаруживается гипометаболизм в островковой коре, надкраевой и нижней лобной извилинах [Su, 2018]. В этом отношении обнаруженные корреляции не являются необычными и отражают патогенез развития депрессивного синдрома.
Выявленные отрицательные корреляции шкал обсессивно-компульсивной симптоматики и фобии с СМГ в височной коре (ПБ20) не так просто объяснить. ПБ20 считается связанной с процессами речи и памяти. В литературе есть данные о том, что ВИЧ-ассоциированные нейрокогнитивные расстройства часто характеризуются нарушениями кратковременной памяти, при этом наблюдается снижение функции медиальных отделов височной доли [Ellis, 2009]. В то же время выявленные корреляции могут быть и следствием особенностей патогенетических механизмов формирования обсессивно-компульсивной и фобической симптоматик, что не противоречит литературным данным [Hazari, 2019].
Таким образом, были выявлены взаимосвязи когнитивных функций и психоэмоционального состояния с СМГ, обобщенно представленные на рис. 2, на котором видно, что (за небольшим исключением) с изменениями в когнитивном статусе и психоэмоциональном состоянии связано функциональное состояние одних и тех же областей коры. Совпадающие области (лобные, теменные и цингулярные) связаны с исполнительными функциями. Согласно исследованию [Kübler, 2006], лобная (ПБ 8, 9, 46) и теменная кора (ПБ 39, 40) селективно активируются в тестах, для выполнения которых необходимо задействование исполнительных функций.
Несмотря на кажущуюся противоречивость результатов, несомненным представляется тот факт, что в патогенезе и когнитивных, и психоэмоциональных нарушений у данных пациентов ключевую роль играет нарушение исполнительных функций (т.е. когнитивных механизмов, оптимизирующих мозговую деятельность для синхронизации нескольких различных психических процессов, в частности, при планировании последовательности этапов, необходимых для выполнения некоторого целенаправленного действия [Baddeley, 1998; Handbook of Executive, 2014; McIntosh, 2015]). В литературе также имеются указания на нарушение исполнительных функций у ВИЧ-инфицированных пациентов: так, при у ВИЧ-положительных пациентов наблюдаются нарушение регуляции внимания и связанные с этим нарушения оперативной памяти [16; 26].
Поясная кора является частью лимбической системы и участвует в контроле и регуляции движений, когнитивных функций, ноцицепции, эмоций, нарушения которых встречаются при ВИЧ-инфекции [Незнанов, 2010; Незнанов, 2018; Anderson; Cohen, 2018]. Многие исследователи указывали на взаимосвязь выявляемых на ранней стадии ВИЧ-инфекции апатии и депрессии с нейротоксическим или нейровоспалительным повреждением аффективной фронто-стриарной системы, в которую входит и передняя поясная извилина [Du Plessis, 2014; Hinkin, 2002; McIntosh, 2015; Woods, 2009].
Изменения функционального состояния передней поясной
извилины часто связывают с преморбидными акцентуациями личности (возбудимость,
дистимия, циклотимия и др.), проявляющимися в склонности к риску, преобладании
гедонистической мотивации, которые могут быть фактором риска инфицирования ВИЧ.
Согласно результатам исследования, копинг-стратегии у ВИЧ-инфицированных
пациентов противоречивы: импульсивность и возбудимость сочетаются с
пассивностью и «бегством от проблем», при этом они достаточно стабильны
независимо от продолжительности заболевания и, вероятно, формируются до
инфицирования [Незнанов, 2010]. В тех случаях, когда наблюдалось употребление пациентами
психоактивных веществ, в поведении обнаруживались психопатоподобные черты,
возникшие до инфицирования, и низкий уровень тревоги по отношению к заболеванию
[Незнанов, 2010]. B.A. Anderson и коллеги [Anderson] также сообщают о характерной для пациентов
импульсивности в принятии решений

Изменения метаболизма в поясной коре не являются специфичными и обнаруживаются при многих заболеваниях: шизофрении, депрессии, обсессивно-компульсивном расстройстве [21; 31, 32]. Таким образом, очевидно, что ВИЧ-инфекция сопровождается поражением нервной системы, когнитивными и психоэмоциональными нарушениями, но вопрос о том, на каком этапе развития заболевания это происходит, остается открытым. Вероятно, что определенные особенности, в числе которых нарушение исполнительных функций, существуют у пациентов исходно, но на фоне токсического действия вируса и связанной с болезнью стрессовой ситуации они прогрессируют.
Выводы
У ВИЧ-инфицированных пациентов наблюдаются нарушения функционирования ЦНС, выявляемые уже на ранних стадиях после инфицирования. Однако в данной выборке пациентов не было выявлено специфических изменений, отличающих пациентов с ВИЧ от других пациентов с когнитивными или психоэмоциональными нарушениями. Выявленные изменения метаболизма глюкозы и NAA/Cr также неспецифичны. Вероятнее всего, имеющиеся преморбидные особенности усиливаются под влиянием токсического действия ВИЧ и тяжелого психоэмоционального стресса, сопутствующего получению информации об инфицированности.
Показатели когнитивных функций и психоэмоционального состояния коррелируют с метаболизмом коры головного мозга, преимущественно – структур, связанных с исполнительными функциями. Очевидно, что у пациентов данной категории имеет место ослабление исполнительных функций, и поэтому важно включать в программу реабилитации психокоррекционные мероприятия, направленные на тренировку эмоционально-волевой сферы, что должно способствовать также поддержанию когнитивных функций и лучшей социальной адаптации.
Полученные результаты имеют практическое значение, поскольку
ВИЧ-ассоциированные нейрокогнитивные нарушения достаточно распространены
и неблагоприятно влияют на качество жизни и прогноз заболевания. Применение
методов нейровизуализации, а также тщательно подобранного набора методов оценки
психоэмоционального состояния и когнитивных функций может способствовать
раннему выявлению нарушений и объективному мониторингу эффективности лечения
ВИЧ-ассоциированных нарушений.